第64页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
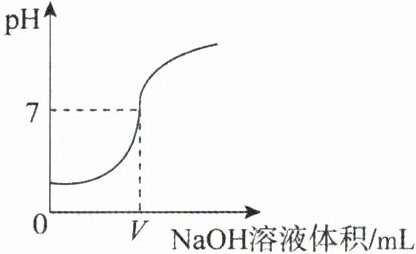
15.将0.4%的氢氧化钠溶液滴加到2mL 0.4%的盐酸中,测得混合液的pH变化曲线如图所示。某学习小组对加入〇~VmL氢氧化钠过程中,所得混合液pH 增大原因进行了如下探究:
[猜想假设]
猜想I:pH增大是因为________________;
猜想II:pH增大是因为发生了反应,写出反应方程式:__________________________。
[实验探究]
为验证猜想II,请你帮助该小组完成下列实验。(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水)
(1)向2mL0.4%的盐酸中加入VmL 0.4%的氢氧化钠溶液,用pH计测得混合液的pH=______。
(2)向2mL0.4%的盐酸中加入VmL ______,用pH计测得混合液的pH______(填“>”“=”或“<”)7。
[猜想假设]
猜想I:pH增大是因为________________;
猜想II:pH增大是因为发生了反应,写出反应方程式:__________________________。
[实验探究]
为验证猜想II,请你帮助该小组完成下列实验。(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水)
(1)向2mL0.4%的盐酸中加入VmL 0.4%的氢氧化钠溶液,用pH计测得混合液的pH=______。
(2)向2mL0.4%的盐酸中加入VmL ______,用pH计测得混合液的pH______(填“>”“=”或“<”)7。

答案:
猜想Ⅰ:混合后溶液体积增大 猜想Ⅱ:$NaOH + HCl = NaCl + H_{2}O$
[实验探究](1)7 (2)水 <
[实验探究](1)7 (2)水 <
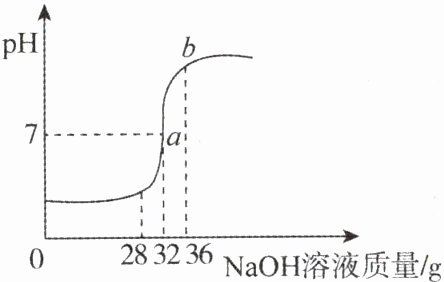
16.(黔西南中考)将5%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请计算:
(1)当恰好完全反应时,消耗NaOH溶液的质量为______克。
(2)请计算稀盐酸中溶质的质量分数(写出计算过程)。
(1)当恰好完全反应时,消耗NaOH溶液的质量为______克。
(2)请计算稀盐酸中溶质的质量分数(写出计算过程)。

答案:
(1)32
(2)解:由图可以看出,$pH = 7$时也就是恰好完全反应时消耗的氢氧化钠溶液的质量为 32g。所含溶质的质量为$32g×5\% = 1.6g$。
设消耗的$HCl$的质量为$x$。
$NaOH + HCl = NaCl + H_{2}O$
40 36.5
1.6g $x$
$\frac{40}{36.5} = \frac{1.6g}{x}$ 解得:$x = 1.46g$
稀盐酸中溶质的质量分数为$\frac{1.46g}{20g}×100\% = 7.3\%$。
答:稀盐酸中溶质的质量分数为 7.3%。
(2)解:由图可以看出,$pH = 7$时也就是恰好完全反应时消耗的氢氧化钠溶液的质量为 32g。所含溶质的质量为$32g×5\% = 1.6g$。
设消耗的$HCl$的质量为$x$。
$NaOH + HCl = NaCl + H_{2}O$
40 36.5
1.6g $x$
$\frac{40}{36.5} = \frac{1.6g}{x}$ 解得:$x = 1.46g$
稀盐酸中溶质的质量分数为$\frac{1.46g}{20g}×100\% = 7.3\%$。
答:稀盐酸中溶质的质量分数为 7.3%。
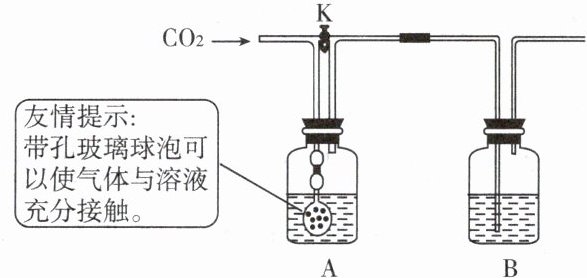
17.小刚和小丽两位同学用下图所示装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应。
(1)小刚关闭K,通入二氧化碳,A、B中均无明显变化。B中盛放__________________溶液。
(2)小刚打开K,继续通入二氧化碳。B中反应的化学方程式为____________________。此步实验目的是______。
小丽认为:通常状况下,1体积的水约能溶解1体积二氧化碳,因此上述实验不足以证明二氧化碳和氢氧化钠发生了反应。
(3)小丽用洗涤干净的上述装置重新实验,分别量取50mL上述溶液放入A、B中,关闭K,通入约500mL二氧化碳,A、B中均无明显变化。此实验可以说明二氧化碳和氢氧化钠发生了反应,其理由是________。
(1)小刚关闭K,通入二氧化碳,A、B中均无明显变化。B中盛放__________________溶液。
(2)小刚打开K,继续通入二氧化碳。B中反应的化学方程式为____________________。此步实验目的是______。
小丽认为:通常状况下,1体积的水约能溶解1体积二氧化碳,因此上述实验不足以证明二氧化碳和氢氧化钠发生了反应。
(3)小丽用洗涤干净的上述装置重新实验,分别量取50mL上述溶液放入A、B中,关闭K,通入约500mL二氧化碳,A、B中均无明显变化。此实验可以说明二氧化碳和氢氧化钠发生了反应,其理由是________。

答案:
(1)$Ca(OH)_{2}$(或氢氧化钙)
(2)$CO_{2} + Ca(OH)_{2} = CaCO_{3}\downarrow + H_{2}O$
验证$CO_{2}$与$Ca(OH)_{2}$能发生反应
(3)关闭 K 时,B 中的溶液无明显变化,且通入的$CO_{2}$气体体积远大于 A 中溶液的体积,说明$CO_{2}$和$NaOH$发生了反应
(2)$CO_{2} + Ca(OH)_{2} = CaCO_{3}\downarrow + H_{2}O$
验证$CO_{2}$与$Ca(OH)_{2}$能发生反应
(3)关闭 K 时,B 中的溶液无明显变化,且通入的$CO_{2}$气体体积远大于 A 中溶液的体积,说明$CO_{2}$和$NaOH$发生了反应
查看更多完整答案,请扫码查看


