2025年点金训练精讲巧练高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年点金训练精讲巧练高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
1. 自然界中硫元素的转化如图所示。下列说法错误的是(
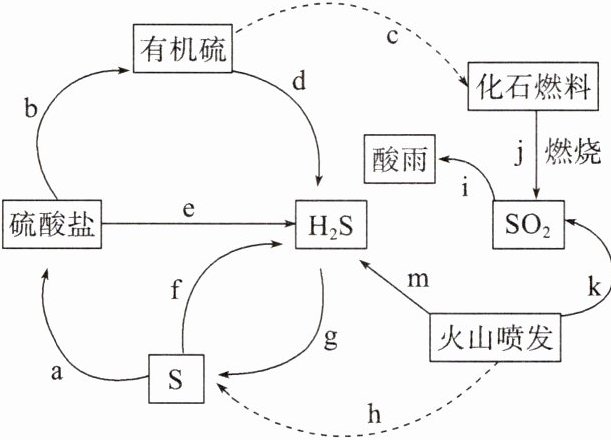
A.步骤a、j的转化需要加入氧化剂才能实现
B.${H_{2}S}$在氧化还原反应中只能表现还原性
C.在燃煤中添加生石灰可减少${SO_{2}}$的排放
D.用盐酸和${BaCl_{2}}$溶液可以检验可溶性硫酸盐中的阴离子
B
)
A.步骤a、j的转化需要加入氧化剂才能实现
B.${H_{2}S}$在氧化还原反应中只能表现还原性
C.在燃煤中添加生石灰可减少${SO_{2}}$的排放
D.用盐酸和${BaCl_{2}}$溶液可以检验可溶性硫酸盐中的阴离子
答案:
1.B 解析:步骤a为S转化成硫酸盐,步骤j为化石燃料的燃烧,均为氧化反应,需要加入氧化剂才能实现,故A正确;H₂S溶液和活泼金属反应时,H₂S表现氧化性,故B错误;燃煤中添加CaO,可以与燃烧生成的SO₂反应生成CaSO₃,再被氧化为CaSO₄,可有效地减少SO₂的排放,故C正确;检验SO₄²⁻的方法为先加过量稀盐酸,没有明显现象,再加BaCl₂溶液,若有白色沉淀生成,则说明有SO₄²⁻,故D正确。
2. 硫元素的价—类二维图如下图所示。下列说法错误的是(
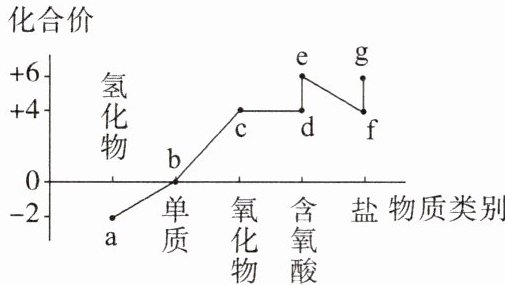
A.d溶液久置于空气中会生成e,溶液的pH减小
B.a与c、a与e都有可能发生反应生成b
C.c通入${BaCl_{2}}$溶液中,产生白色沉淀
D.g与f之间可能发生反应
C
)
A.d溶液久置于空气中会生成e,溶液的pH减小
B.a与c、a与e都有可能发生反应生成b
C.c通入${BaCl_{2}}$溶液中,产生白色沉淀
D.g与f之间可能发生反应
答案:
2.C 解析:根据化合价以及物质的类别可知a为H₂S,b为S,c为SO₂,d为H₂SO₃,e为H₂SO₄,f含有SO₃²⁻或HSO₃⁻,g含有SO₄²⁻或HSO₄⁻。H₂SO₃具有较强的还原性,在空气中久置会被氧气氧化为H₂SO₄,H₂SO₄的酸性更强,pH更小,故A正确;a为H₂S,可以和SO₂、H₂SO₄发生归中反应生成S,故B正确;盐酸的酸性强于亚硫酸,故SO₂与BaCl₂溶液不能发生反应生成沉淀,故C错误;g为硫酸盐或酸式盐,f为亚硫酸盐,g与f可能会发生反应生成SO₂,故D正确。
3. 人们认识和应用物质常从两方面入手,一是从物质的类别认识该物质可能跟哪些物质发生反应;二是从物质所含元素的化合价分析该物质是否具有氧化性或还原性。硫元素的各种价态与物质类别的对应关系如下图所示:
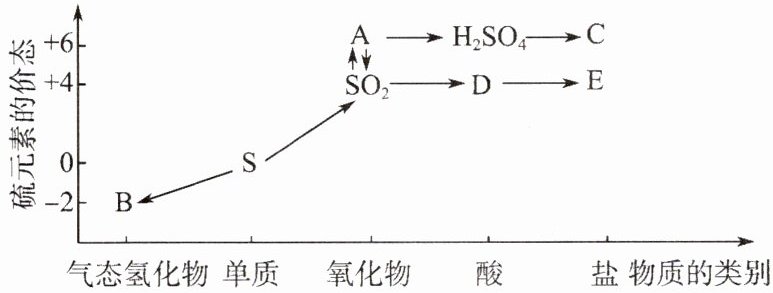
(1) 写出指定物质的化学式:A
(2) D转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式: ________。
(3) 若C是铜盐,试写出由${H_{2}SO_{4}\to C}$的化学方程式:
(4) 为进一步减少${SO_{2}}$的污染并变废为宝,我国正在探索在一定条件下用${CO}$还原${SO_{2}}$得到单质硫的方法来除去${SO_{2}}$。写出该反应的化学方程式:

(1) 写出指定物质的化学式:A
SO₃
,B H₂S
。(2) D转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式: ________。
(3) 若C是铜盐,试写出由${H_{2}SO_{4}\to C}$的化学方程式:
Cu + 2H₂SO₄(浓) =△= CuSO₄ + SO₂↑ + 2H₂O
。(4) 为进一步减少${SO_{2}}$的污染并变废为宝,我国正在探索在一定条件下用${CO}$还原${SO_{2}}$得到单质硫的方法来除去${SO_{2}}$。写出该反应的化学方程式:
2CO + SO₂ =一定条件= S + 2CO₂
。
答案:
3.解析:A中S元素的化合价为+6价,且A为氧化物,因此A为三氧化硫;B中S元素的化合价为-2价,且B为气态氢化物,因此B为硫化氢;C为铜盐,且由硫酸反应得到,因此C为硫酸铜;由硫元素的价态及对应物质的类别可知,D为亚硫酸,E为亚硫酸盐。答案:
(1)SO₃;H₂S;
(2)2H₂SO₃ + O₂ = 2H₂SO₄;
(3)Cu + 2H₂SO₄(浓) =△= CuSO₄ + SO₂↑ + 2H₂O(其他合理答案也可);
(4)2CO + SO₂ =一定条件= S + 2CO₂
(1)SO₃;H₂S;
(2)2H₂SO₃ + O₂ = 2H₂SO₄;
(3)Cu + 2H₂SO₄(浓) =△= CuSO₄ + SO₂↑ + 2H₂O(其他合理答案也可);
(4)2CO + SO₂ =一定条件= S + 2CO₂
查看更多完整答案,请扫码查看


