2025年阳光夺冠九年级化学下册
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年阳光夺冠九年级化学下册 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第67页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
1. 一般说来,大多数作物适宜在中性或接近中性的土壤中生长。经测定某土壤的pH为5.5,要改良它,应在土壤中施加适量的( )
A. 氢氧化钠
B. 熟石灰
C. 食盐
D. 盐酸
A. 氢氧化钠
B. 熟石灰
C. 食盐
D. 盐酸
答案:
B
2. 芋艿(俗称毛芋)是一种常见的食品,新鲜芋艿在去皮时会出现一种白色的汁液,汁液内含有一种碱性物质——皂角甙,沾上它会奇痒难忍,下列厨房中的物质止痒效果最好的是( )
A. 食醋
B. 料酒
C. 纯碱
D. 食盐水
A. 食醋
B. 料酒
C. 纯碱
D. 食盐水
答案:
A
3. 下列有关酸雨的说法正确的是( )
A. 显酸性的降雨即为酸雨
B. 酸雨是指pH<5.6的降雨
C. 由于空气中二氧化碳含量过多,导致酸雨的形成
D. 随时监测雨水的pH,可以有效地解决其对农作物和建筑物等造成的不良影响
A. 显酸性的降雨即为酸雨
B. 酸雨是指pH<5.6的降雨
C. 由于空气中二氧化碳含量过多,导致酸雨的形成
D. 随时监测雨水的pH,可以有效地解决其对农作物和建筑物等造成的不良影响
答案:
B
4. 下列没有运用中和反应原理的是( )
A. 服用含氢氧化铝的药物,可以治疗胃酸过多症
B. 用熟石灰来处理酸性污水
C. 松花蛋中含有碱性物质,人们食用它时常加一些醋
D. 用生石灰作干燥剂
A. 服用含氢氧化铝的药物,可以治疗胃酸过多症
B. 用熟石灰来处理酸性污水
C. 松花蛋中含有碱性物质,人们食用它时常加一些醋
D. 用生石灰作干燥剂
答案:
D
5. 下列物质能与稀盐酸发生中和反应的是( )
A. 硝酸银
B. 氧化铜
C. 石灰水
D. 锌
A. 硝酸银
B. 氧化铜
C. 石灰水
D. 锌
答案:
C
6. 下列反应属于中和反应的是( )
A. 2HCl + CuO = CuCl₂ + H₂O
B. 2NaOH + CO₂ = Na₂CO₃ + H₂O
C. 2HCl + Ca(OH)₂ = CaCl₂ + 2H₂O
D. CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
A. 2HCl + CuO = CuCl₂ + H₂O
B. 2NaOH + CO₂ = Na₂CO₃ + H₂O
C. 2HCl + Ca(OH)₂ = CaCl₂ + 2H₂O
D. CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
答案:
C
7. 中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是( )
A. 用熟石灰改良酸性土壤
B. 用含氢氧化镁的药物治疗胃酸过多
C. 用盐酸除去铁锈
D. 用氨水(NH₃·H₂O)处理工厂的硫酸
A. 用熟石灰改良酸性土壤
B. 用含氢氧化镁的药物治疗胃酸过多
C. 用盐酸除去铁锈
D. 用氨水(NH₃·H₂O)处理工厂的硫酸
答案:
C
8. 氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法不正确的是( )
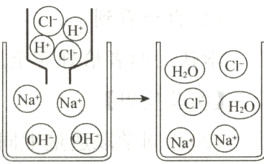
A. 盐酸中存在的微粒有水分子和氯化氢分子
B. 该反应的微观实质是H⁺和OH⁻结合生成水分子
C. Na⁺和Cl⁻在该反应过程中没有被消耗
D. 恰好完全反应时,溶液呈中性

A. 盐酸中存在的微粒有水分子和氯化氢分子
B. 该反应的微观实质是H⁺和OH⁻结合生成水分子
C. Na⁺和Cl⁻在该反应过程中没有被消耗
D. 恰好完全反应时,溶液呈中性
答案:
B
9. 同样是清洁剂,炉具清洁剂有强碱性,而厕所清洁剂则有强酸性,用这两种清洁剂进行实验得到的结果一定有误的是( )
A. 测得炉具清洁剂pH = 13
B. 测得厕所清洁剂pH = 8
C. 炉具清洁剂使无色酚酞溶液变红
D. 厕所清洁剂使紫色石蕊溶液变红
A. 测得炉具清洁剂pH = 13
B. 测得厕所清洁剂pH = 8
C. 炉具清洁剂使无色酚酞溶液变红
D. 厕所清洁剂使紫色石蕊溶液变红
答案:
B
10. 将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如右图所示。下列有关说法不正确的是( )
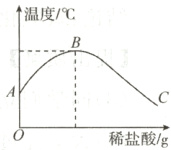
A. 说明该反应过程中放热
B. 图中B点表示稀盐酸与氢氧化钠溶液恰好完全反应
C. 图中C处溶液中的溶质为NaCl和HCl
D. 从A到B过程中,烧杯中溶液的pH逐渐变大

A. 说明该反应过程中放热
B. 图中B点表示稀盐酸与氢氧化钠溶液恰好完全反应
C. 图中C处溶液中的溶质为NaCl和HCl
D. 从A到B过程中,烧杯中溶液的pH逐渐变大
答案:
B
11. 研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验。下列选项错误的是( )


答案:
C
12. 烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH变化如下图所示。则符合该变化的一组物质是( )
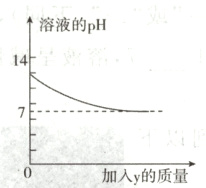
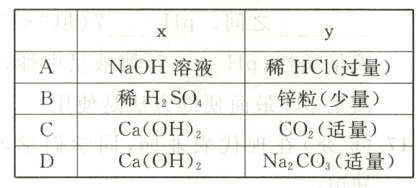


答案:
C
13. 25℃时,向20.0 mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列有关叙述正确的是( )
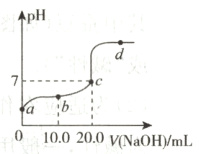
A. b、d点对应溶液的pH:b>d
B. 所用氢氧化钠溶液的质量分数一定为30%
C. 向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D. d点对应的溶液中溶质是NaCl和NaOH

A. b、d点对应溶液的pH:b>d
B. 所用氢氧化钠溶液的质量分数一定为30%
C. 向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D. d点对应的溶液中溶质是NaCl和NaOH
答案:
D
14. 某环保小组监测到某小型造纸厂向河中非法排放废液,他们对废液进行下列实验,根据实验现象得出的结论中,不正确的是( )
A. 测定废液的pH大于7,则该废液显碱性
B. 滴入酚酞溶液,溶液变红色,则该废液显碱性
C. 滴入紫色石蕊溶液,颜色变蓝色,则该废液显碱性
D. 通入二氧化碳气体,溶液无明显变化,则该废液显碱性
A. 测定废液的pH大于7,则该废液显碱性
B. 滴入酚酞溶液,溶液变红色,则该废液显碱性
C. 滴入紫色石蕊溶液,颜色变蓝色,则该废液显碱性
D. 通入二氧化碳气体,溶液无明显变化,则该废液显碱性
答案:
D
15. 实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
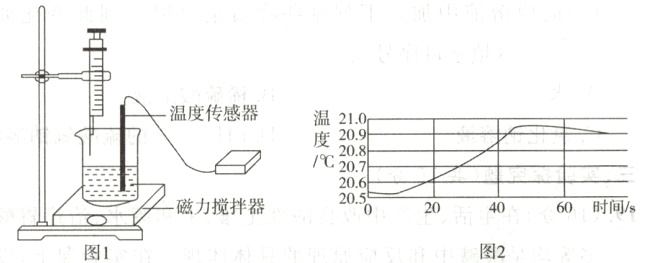
A. 烧杯中只能盛放稀氢氧化钠溶液
B. 图2不能证明反应是放热反应
C. 60 s时溶液中溶质只有氯化钠
D. 实验证明氢氧化钠与盐酸能反应

A. 烧杯中只能盛放稀氢氧化钠溶液
B. 图2不能证明反应是放热反应
C. 60 s时溶液中溶质只有氯化钠
D. 实验证明氢氧化钠与盐酸能反应
答案:
D
16.(10分)溶液的酸碱度常用pH来表示,pH的范围通常在________之间。pH____7(填“<”“=”或“>”,下同),溶液呈酸性;pH____7,溶液呈中性;pH____7,溶液呈碱性。测定pH最简便的方法是使用______________。
答案:
0~14 < = > pH试纸
17.(6分)在现代农业园,同学们学习到以下知识:

(1)不同的植物生长所需要的土壤酸碱度不同,几种常见农作物生长所需的pH如下:
A. 土豆(4.8~6.0) B. 蚕豆(7~8) C. 茄子(6.8~7.3)
其中蚕豆(如图)的生长环境属于________(填“酸性”“中性”或“碱性”)。
(2)为适应农作物生长,有时需要改良土壤,将酸性土壤改良为碱性,一般用________________。

(1)不同的植物生长所需要的土壤酸碱度不同,几种常见农作物生长所需的pH如下:
A. 土豆(4.8~6.0) B. 蚕豆(7~8) C. 茄子(6.8~7.3)
其中蚕豆(如图)的生长环境属于________(填“酸性”“中性”或“碱性”)。
(2)为适应农作物生长,有时需要改良土壤,将酸性土壤改良为碱性,一般用________________。
答案:
(1)碱性
(2)熟石灰(氢氧化钙)
(1)碱性
(2)熟石灰(氢氧化钙)
18.(15分)在用盐酸和氢氧化钡溶液进行中和反应的实验时,反应过程中溶液的pH的变化曲线如下图所示:
(1)要得到此变化曲线,所进行的操作是________(填序号);
①将稀盐酸滴加到氢氧化钡溶液中
②将氢氧化钡溶液滴加到稀盐酸中
(2)该反应的化学方程式为________________________;
(3)丙点溶液中所含溶质的离子有Ba²⁺、________(填离子符号);
(4)若向甲、乙、丙三点中加入氯化铜溶液,会出现蓝色沉淀的是________点;
(5)向原溶液中加入下列哪些物质也可以得到此变化曲线________(填字母序号)。
A. 水
B. 稀硫酸溶液
C. 氯化钠溶液
D. pH = 1.5的硫酸氢钠溶液
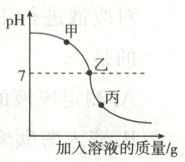
(1)要得到此变化曲线,所进行的操作是________(填序号);
①将稀盐酸滴加到氢氧化钡溶液中
②将氢氧化钡溶液滴加到稀盐酸中
(2)该反应的化学方程式为________________________;
(3)丙点溶液中所含溶质的离子有Ba²⁺、________(填离子符号);
(4)若向甲、乙、丙三点中加入氯化铜溶液,会出现蓝色沉淀的是________点;
(5)向原溶液中加入下列哪些物质也可以得到此变化曲线________(填字母序号)。
A. 水
B. 稀硫酸溶液
C. 氯化钠溶液
D. pH = 1.5的硫酸氢钠溶液

答案:
(1)①
(2)$2HCl + Ba(OH)_2 = BaCl_2 + 2H_2O$
(3)$Cl^-$、$H^+$
(4)甲
(5)BD
(1)①
(2)$2HCl + Ba(OH)_2 = BaCl_2 + 2H_2O$
(3)$Cl^-$、$H^+$
(4)甲
(5)BD
三、实验探究题(共16分)
19.(16分)在生活、生产中改良酸性土壤、中和废水、治疗胃酸过多等均是酸碱中和反应原理的具体体现。在实验课上,发现有部分中和反应现象并不明显。
【提出问题】以氢氧化钠溶液与盐酸为例,如何证明它们发生中和反应了呢?
【设计实验】
方案一:甲同学利用酸碱指示剂的变色来证明两者反应,进行了下列操作。
步骤一:取一定量的氢氧化钠溶液于小烧杯中,滴加2~3滴无色酚酞试液;
步骤二:用胶头滴管吸取稀盐酸,逐滴滴入烧杯中,边滴边用玻璃棒搅拌。
(1)直至看到________________________现象时,甲同学认为两者恰好完全反应了。
【实验反思】
(2)乙同学取适量甲同学实验后的溶液于试管中继续探究,下列方法能说明两者是否恰好完全反应的是______。(填字母)
A. 再滴一滴稀盐酸,溶液呈无色
B. 再滴一滴稀盐酸,溶液呈红色
C. 再滴一滴氢氧化钠溶液,溶液呈无色
D. 再滴一滴氢氧化钠溶液,溶液呈红色
方案二:有同学认为,可以通过检验是否有氯化钠生成来证明氢氧化钠溶液与盐酸的反应,于是用玻璃棒蘸取甲同学实验后的溶液放在酒精灯上蒸干,发现有白色固体析出,从而得出结论:氢氧化钠溶液确实与盐酸反应生成了氯化钠。
【提出质疑】
(3)同学们立即表示反对,因为________________________。
(4)大家经过商量决定将白色固体溶解于少量水中,再检验白色固体成分,下列药品可行的是______(填字母)。
A. CuSO₄溶液
B. 稀盐酸
C. 酚酞溶液
D. CO₂
【拓展延伸】还有同学想到中和反应生成盐和水,于是利用水的生成来说明酸和碱反应。
【查阅资料】Ⅰ. 变色硅胶吸水后由蓝色变为红色。
Ⅱ. 无水醋酸与氢氧化钠反应生成醋酸钠和水。
同学们经过讨论设计了下列三个实验:

(5)证明无水醋酸与氢氧化钠反应的现象是________________________。
(6)造成丙中U形管左侧液面降低、右侧液面升高的原因可能是:________________________。
【反思总结】
在老师的指导下,同学们终于找到了证明中和反应发生的方法,主要通过两条途径:a. 证明反应物减少了;b. 证明新物质的生成。
(7)请你再写出一个不属于中和反应并且没有明显现象的反应:________________________。(用化学方程式表示)
(8)综上两个中和反应,他们的微观本质都是________________________。
19.(16分)在生活、生产中改良酸性土壤、中和废水、治疗胃酸过多等均是酸碱中和反应原理的具体体现。在实验课上,发现有部分中和反应现象并不明显。
【提出问题】以氢氧化钠溶液与盐酸为例,如何证明它们发生中和反应了呢?
【设计实验】
方案一:甲同学利用酸碱指示剂的变色来证明两者反应,进行了下列操作。
步骤一:取一定量的氢氧化钠溶液于小烧杯中,滴加2~3滴无色酚酞试液;
步骤二:用胶头滴管吸取稀盐酸,逐滴滴入烧杯中,边滴边用玻璃棒搅拌。
(1)直至看到________________________现象时,甲同学认为两者恰好完全反应了。
【实验反思】
(2)乙同学取适量甲同学实验后的溶液于试管中继续探究,下列方法能说明两者是否恰好完全反应的是______。(填字母)
A. 再滴一滴稀盐酸,溶液呈无色
B. 再滴一滴稀盐酸,溶液呈红色
C. 再滴一滴氢氧化钠溶液,溶液呈无色
D. 再滴一滴氢氧化钠溶液,溶液呈红色
方案二:有同学认为,可以通过检验是否有氯化钠生成来证明氢氧化钠溶液与盐酸的反应,于是用玻璃棒蘸取甲同学实验后的溶液放在酒精灯上蒸干,发现有白色固体析出,从而得出结论:氢氧化钠溶液确实与盐酸反应生成了氯化钠。
【提出质疑】
(3)同学们立即表示反对,因为________________________。
(4)大家经过商量决定将白色固体溶解于少量水中,再检验白色固体成分,下列药品可行的是______(填字母)。
A. CuSO₄溶液
B. 稀盐酸
C. 酚酞溶液
D. CO₂
【拓展延伸】还有同学想到中和反应生成盐和水,于是利用水的生成来说明酸和碱反应。
【查阅资料】Ⅰ. 变色硅胶吸水后由蓝色变为红色。
Ⅱ. 无水醋酸与氢氧化钠反应生成醋酸钠和水。
同学们经过讨论设计了下列三个实验:

(5)证明无水醋酸与氢氧化钠反应的现象是________________________。
(6)造成丙中U形管左侧液面降低、右侧液面升高的原因可能是:________________________。
【反思总结】
在老师的指导下,同学们终于找到了证明中和反应发生的方法,主要通过两条途径:a. 证明反应物减少了;b. 证明新物质的生成。
(7)请你再写出一个不属于中和反应并且没有明显现象的反应:________________________。(用化学方程式表示)
(8)综上两个中和反应,他们的微观本质都是________________________。
答案:
(1)溶液恰好由红色变为无色
(2)C
(3)白色固体也有可能是氢氧化钠
(4)AC
(5)甲乙中变色硅胶不变色,仍然为蓝色,丙中变色硅胶由蓝色变为红色
(6)氢氧化钠和无水醋酸发生中和反应,中和反应放热
(7)$CO_2 + 2NaOH = Na_2CO_3 + H_2O$(合理即可)
(8)氢离子与氢氧根离子结合生成水分子
(1)溶液恰好由红色变为无色
(2)C
(3)白色固体也有可能是氢氧化钠
(4)AC
(5)甲乙中变色硅胶不变色,仍然为蓝色,丙中变色硅胶由蓝色变为红色
(6)氢氧化钠和无水醋酸发生中和反应,中和反应放热
(7)$CO_2 + 2NaOH = Na_2CO_3 + H_2O$(合理即可)
(8)氢离子与氢氧根离子结合生成水分子
四、计算题(共8分)
20.(8分)实验室有两瓶标签模糊的溶液,分别是溶质质量分数均为8%的NaOH和KOH溶液。为了鉴别这两瓶溶液,首先在这两个试剂瓶上贴上标签A、B以示区别,然后取A、B溶液各20克,分别加入烧杯中,用溶质质量分数为7.3%的稀盐酸中和,消耗盐酸的质量与烧杯中溶液的总质量如下图所示:


已知:P、Q两点溶液呈中性,则:
(1)溶液B的溶质是______(写化学式);
(2)求出m、n的值(写出计算过程,并保留一位小数)。
20.(8分)实验室有两瓶标签模糊的溶液,分别是溶质质量分数均为8%的NaOH和KOH溶液。为了鉴别这两瓶溶液,首先在这两个试剂瓶上贴上标签A、B以示区别,然后取A、B溶液各20克,分别加入烧杯中,用溶质质量分数为7.3%的稀盐酸中和,消耗盐酸的质量与烧杯中溶液的总质量如下图所示:


已知:P、Q两点溶液呈中性,则:
(1)溶液B的溶质是______(写化学式);
(2)求出m、n的值(写出计算过程,并保留一位小数)。
答案:
(1)NaOH
(2)$m = 14.3g$,$n = 34.3g$
(1)NaOH
(2)$m = 14.3g$,$n = 34.3g$
1.(重庆中考)教材里学生实验《溶液酸碱性的检验》中,下列实验仪器或药品不会用到的是( )
A. 集气瓶
B. 玻璃棒
C. 土壤样品
D. 石蕊溶液
A. 集气瓶
B. 玻璃棒
C. 土壤样品
D. 石蕊溶液
答案:
A
2. 从物质的组成角度解释酸具有相似化学性质的原因是( )
A. 酸都能在水中电离出H⁺
B. 酸都含有酸根
C. 酸中都含有氢气
D. 酸中都含有氧元素
A. 酸都能在水中电离出H⁺
B. 酸都含有酸根
C. 酸中都含有氢气
D. 酸中都含有氧元素
答案:
A
3. 下列物质的用途错误的是(____)
A. 盐酸除铁锈
B. 浓硫酸用作气体干燥剂
C. 氢氧化钠用于改良酸性土壤
D. 氢氧化钙用于配制农药波尔多液
A. 盐酸除铁锈
B. 浓硫酸用作气体干燥剂
C. 氢氧化钠用于改良酸性土壤
D. 氢氧化钙用于配制农药波尔多液
答案:
C
4. 生活中,下列溶液的pH>7的是( )
A. 汽水
B. 食盐水
C. 消毒液
D. 食醋
A. 汽水
B. 食盐水
C. 消毒液
D. 食醋
答案:
C
5. 稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是( )
A. 除去氯化钠溶液中的碳酸钠
B. 除去铜粉中混有的铁粉
C. 除去熟石灰中的石灰石
D. 除去铁丝上的铁锈
A. 除去氯化钠溶液中的碳酸钠
B. 除去铜粉中混有的铁粉
C. 除去熟石灰中的石灰石
D. 除去铁丝上的铁锈
答案:
C
6. 盐酸、硫酸、氢氧化钠、氢氧化钙是初中化学中的常见物质,下列关于这几种物质的说法正确的是( )
A. 浓硫酸是无色、粘稠、油状液体,有很强的挥发性
B. 氢氧化钙的俗名是生石灰、熟石灰、消石灰
C. 盐酸是胃酸的主要成分,可用于除锈和帮助消化食物
D. 氢氧化钠固体在空气极易潮解,溶于水温度降低
A. 浓硫酸是无色、粘稠、油状液体,有很强的挥发性
B. 氢氧化钙的俗名是生石灰、熟石灰、消石灰
C. 盐酸是胃酸的主要成分,可用于除锈和帮助消化食物
D. 氢氧化钠固体在空气极易潮解,溶于水温度降低
答案:
A
7.(怀化中考)下列实验现象描述正确的是( )
A. 铁丝在氧气中剧烈燃烧、火星四射、生成黑色固体
B. 红磷在空气里燃烧生成白色烟雾
C. 打开浓硫酸试剂瓶瓶盖,观察到有白雾形成
D. 向氢氧化钠溶液中滴加酚酞溶液,溶液变成蓝色
A. 铁丝在氧气中剧烈燃烧、火星四射、生成黑色固体
B. 红磷在空气里燃烧生成白色烟雾
C. 打开浓硫酸试剂瓶瓶盖,观察到有白雾形成
D. 向氢氧化钠溶液中滴加酚酞溶液,溶液变成蓝色
答案:
A
查看更多完整答案,请扫码查看


