2025年授之以渔中考试题汇编九年级化学全一册人教版河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年授之以渔中考试题汇编九年级化学全一册人教版河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
16. (5分)根据图11所示的实验回答问题。
(1)甲是探究铁生锈条件的实验。图中①②③处均为光亮的铁丝绒。对比
(2)乙是探究热量变化的实验。将两装置中胶头滴管内的液体滴入铁槽中后,④⑤中的白磷都发生燃烧,说明④中的反应
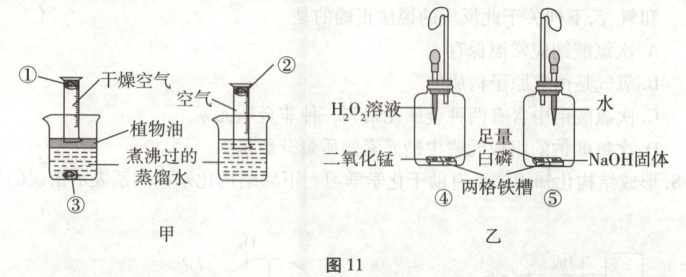
(1)甲是探究铁生锈条件的实验。图中①②③处均为光亮的铁丝绒。对比
②③
(填序号)的现象,可得铁生锈的条件之一为与氧气接触。植物油的作用为隔绝氧气(或隔绝水,合理即可)
。(2)乙是探究热量变化的实验。将两装置中胶头滴管内的液体滴入铁槽中后,④⑤中的白磷都发生燃烧,说明④中的反应
放出
(选填“吸收”或“放出”)热量;④中白磷燃烧得更剧烈,说明燃烧的剧烈程度与氧气浓度
有关。对比⑤装置滴入液体前后的现象,可得出可燃物燃烧的条件之一为温度达到可燃物的着火点
。
答案:
16.
(1)②③ 隔绝氧气(或隔绝水,合理即可)
(2)放出 氧气浓度 温度达到可燃物的着火点
解析:本题考查探究铁生锈条件的实验、探究热量变化的实验。
(1)在甲实验中,①处铁丝绒只与空气(或氧气)接触,②处铁丝绒同时与空气(或氧气)和水接触,③处铁丝绒只与水接触,对比②与③可知,铁生锈的必要条件之一是与氧气接触;植物油的作用是使①处铁丝绒隔绝水,使③处铁丝绒隔绝氧气。
(2)在乙实验中,向装有$MnO_2$的装置④中滴入$H_2O_2$溶液后迅速发生反应,产生$O_2,$白磷迅速燃烧,说明温度达到了白磷的着火点,说明④中的反应放出热量;④中的白磷燃烧更剧烈,说明燃烧的剧烈程度与氧气浓度有关;NaOH固体溶于水放热,对比⑤装置滴入液体前无燃烧、后燃烧的现象,可知要想使可燃物燃烧,周围温度要达到可燃物的着火点。
(1)②③ 隔绝氧气(或隔绝水,合理即可)
(2)放出 氧气浓度 温度达到可燃物的着火点
解析:本题考查探究铁生锈条件的实验、探究热量变化的实验。
(1)在甲实验中,①处铁丝绒只与空气(或氧气)接触,②处铁丝绒同时与空气(或氧气)和水接触,③处铁丝绒只与水接触,对比②与③可知,铁生锈的必要条件之一是与氧气接触;植物油的作用是使①处铁丝绒隔绝水,使③处铁丝绒隔绝氧气。
(2)在乙实验中,向装有$MnO_2$的装置④中滴入$H_2O_2$溶液后迅速发生反应,产生$O_2,$白磷迅速燃烧,说明温度达到了白磷的着火点,说明④中的反应放出热量;④中的白磷燃烧更剧烈,说明燃烧的剧烈程度与氧气浓度有关;NaOH固体溶于水放热,对比⑤装置滴入液体前无燃烧、后燃烧的现象,可知要想使可燃物燃烧,周围温度要达到可燃物的着火点。
17. (7分)中国文化源远流长,我国古代劳动人民积累了很多智慧。《周礼·考工记》中载有“涑帛”的方法,即利用“灰”(草木灰,主要成分为$K_2CO_3$)和“蜃”(贝壳灰,主要成分为$CaO$)混合加水所得溶液洗涤丝帛,使其与丝表面的丝胶蛋白发生反应,用水冲去生成物,就可把丝洗得顺滑亮丽、化学兴趣小组的同学们按照图12所示实验过程,尝试制备洗涤丝帛的溶液$M$并探究其成分(已知:“灰”“蜃”中的杂质不溶于水也不参与反应)。
探究Ⅰ. 制备洗涤丝帛的溶液$M$
(1)$CaO$在实验室中的一种用途为
(2)步骤Ⅱ中加入草木灰时发生反应的化学方程式为
探究Ⅱ. 探究溶液$M$的成分
【提出问题】溶液$M$的成分是什么?
【猜想与假设】猜想一:$KOH$;
猜想二:$KOH$和$K_2CO_3$;
猜想三:
【进行实验】同学们按下表所示进行了实验,并加以分析。
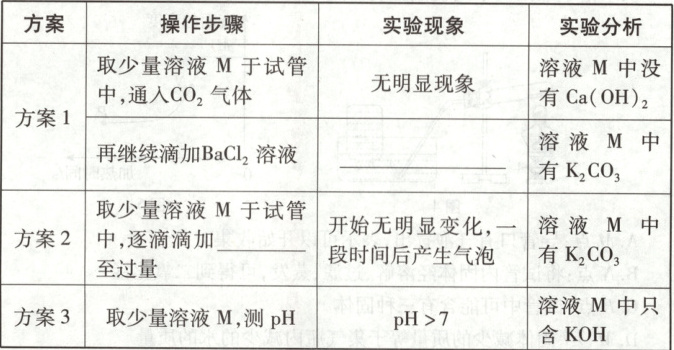
【交流讨论】同学们将实验结果与老师交流,老师分析后指出方案1、3都不严谨,请你从方案1、3中任选一个并说明理由:
【实验结论】同学们最终得出结论:猜想二正确。
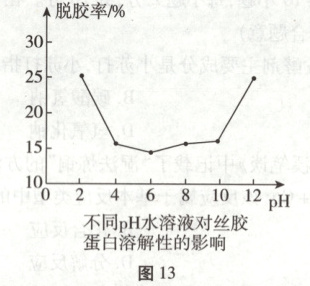
【延伸应用】同学们查阅资料得知,脱胶率越高,所得丝帛越顺滑亮丽、浓度为$10\%$的$K_2CO_3$溶液的$pH = 11.6$,浓度为$1\%$的$KOH$溶液的$pH = 13.2$,根据如图13所示数据分析,选用

探究Ⅰ. 制备洗涤丝帛的溶液$M$
(1)$CaO$在实验室中的一种用途为
作干燥剂
。(2)步骤Ⅱ中加入草木灰时发生反应的化学方程式为
K_2CO_3 + Ca(OH)_2=\!=\!=CaCO_3\downarrow + 2KOH
。探究Ⅱ. 探究溶液$M$的成分
【提出问题】溶液$M$的成分是什么?
【猜想与假设】猜想一:$KOH$;
猜想二:$KOH$和$K_2CO_3$;
猜想三:
KOH和Ca(OH)_2
。【进行实验】同学们按下表所示进行了实验,并加以分析。

【交流讨论】同学们将实验结果与老师交流,老师分析后指出方案1、3都不严谨,请你从方案1、3中任选一个并说明理由:
方案1、3都不严谨,方案1的理由:二氧化碳会与氢氧化钾反应生成碳酸钾,不能确定溶液M中是否含有碳酸钾。方案3的理由:K_2CO_3溶液也显碱性,不能判断只含KOH。
。【实验结论】同学们最终得出结论:猜想二正确。
【延伸应用】同学们查阅资料得知,脱胶率越高,所得丝帛越顺滑亮丽、浓度为$10\%$的$K_2CO_3$溶液的$pH = 11.6$,浓度为$1\%$的$KOH$溶液的$pH = 13.2$,根据如图13所示数据分析,选用
1%的KOH
溶液洗涤丝帛效果更好。

答案:
17.
(1)作干燥剂$ (2)K_2CO_3 + Ca(OH)_2==CaCO_3↓ + 2KOH 【$猜想与假设】KOH和$Ca(OH)_2 【$进行实验】产生白色沉淀 稀硝酸(或稀盐酸等) 【交流讨论】方案1、3都不严谨,方案1的理由:二氧化碳会与氢氧化钾反应生成碳酸钾,不能确定溶液M中是否含有碳酸钾。方案3的理由:$K_2CO_3$溶液也显碱性,不能判断只含KOH。【延伸应用】1%的KOH
解析:本题考查探究溶液中溶质的成分。
(1)CaO可与水反应生成氢氧化钙,所以CaO在实验室中的一种用途为作干燥剂。
(2)贝壳灰的主要成分为CaO,CaO与水反应生成氢氧化钙,草木灰主要成分为$K_2CO_3,$$K_2CO_3$与氢氧化钙反应的化学方程式为$K_2CO_3 + Ca(OH)_2==CaCO_3↓ + 2KOH。$
【猜想与假设$】K_2CO_3$与氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,过滤掉碳酸钙沉淀,若二者恰好完全反应,则溶液M中的溶质为KOH,若$K_2CO_3$过量,则溶液M中的溶质为KOH、$K_2CO_3,$若$Ca(OH)_2$过量,则溶液M中的溶质为KOH、$Ca(OH)_2,$故猜想三为KOH和$Ca(OH)_2。$【进行实验】方案1:由于溶液M中有$K_2CO_3,$$K_2CO_3$与氯化钡反应生成碳酸钡白色沉淀和氯化钾,故实验现象是产生白色沉淀。方案2:实验结论是溶液M中有$K_2CO_3,$$K_2CO_3$与酸反应生成二氧化碳气体,所以一段时间后产生气泡,故应滴加稀硝酸、稀盐酸等。【交流讨论】方案1、3都不严谨,方案1的理由:二氧化碳会与氢氧化钾反应生成碳酸钾,不能确定溶液M中是否含有碳酸钾。方案3的理由:$K_2CO_3$溶液也显碱性,不能判断只含KOH。【延伸应用】据图分析可知,pH>10时,pH越大,脱胶率越高,而脱胶率越高,所得丝帛越顺滑亮丽,浓度为10%的$K_2CO_3$溶液的pH=11.6,浓度为1%的KOH溶液的pH=13.2,故选用1%的KOH溶液洗涤丝帛效果更好。
(1)作干燥剂$ (2)K_2CO_3 + Ca(OH)_2==CaCO_3↓ + 2KOH 【$猜想与假设】KOH和$Ca(OH)_2 【$进行实验】产生白色沉淀 稀硝酸(或稀盐酸等) 【交流讨论】方案1、3都不严谨,方案1的理由:二氧化碳会与氢氧化钾反应生成碳酸钾,不能确定溶液M中是否含有碳酸钾。方案3的理由:$K_2CO_3$溶液也显碱性,不能判断只含KOH。【延伸应用】1%的KOH
解析:本题考查探究溶液中溶质的成分。
(1)CaO可与水反应生成氢氧化钙,所以CaO在实验室中的一种用途为作干燥剂。
(2)贝壳灰的主要成分为CaO,CaO与水反应生成氢氧化钙,草木灰主要成分为$K_2CO_3,$$K_2CO_3$与氢氧化钙反应的化学方程式为$K_2CO_3 + Ca(OH)_2==CaCO_3↓ + 2KOH。$
【猜想与假设$】K_2CO_3$与氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,过滤掉碳酸钙沉淀,若二者恰好完全反应,则溶液M中的溶质为KOH,若$K_2CO_3$过量,则溶液M中的溶质为KOH、$K_2CO_3,$若$Ca(OH)_2$过量,则溶液M中的溶质为KOH、$Ca(OH)_2,$故猜想三为KOH和$Ca(OH)_2。$【进行实验】方案1:由于溶液M中有$K_2CO_3,$$K_2CO_3$与氯化钡反应生成碳酸钡白色沉淀和氯化钾,故实验现象是产生白色沉淀。方案2:实验结论是溶液M中有$K_2CO_3,$$K_2CO_3$与酸反应生成二氧化碳气体,所以一段时间后产生气泡,故应滴加稀硝酸、稀盐酸等。【交流讨论】方案1、3都不严谨,方案1的理由:二氧化碳会与氢氧化钾反应生成碳酸钾,不能确定溶液M中是否含有碳酸钾。方案3的理由:$K_2CO_3$溶液也显碱性,不能判断只含KOH。【延伸应用】据图分析可知,pH>10时,pH越大,脱胶率越高,而脱胶率越高,所得丝帛越顺滑亮丽,浓度为10%的$K_2CO_3$溶液的pH=11.6,浓度为1%的KOH溶液的pH=13.2,故选用1%的KOH溶液洗涤丝帛效果更好。
查看更多完整答案,请扫码查看


