2025年授之以渔中考试题汇编九年级化学全一册人教版河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年授之以渔中考试题汇编九年级化学全一册人教版河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第4页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
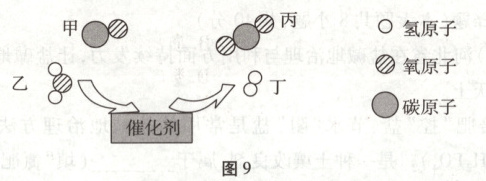
14. (5分)图9所示为工业生产中常用的降低水煤气中CO含量的反应示意图。
请回答下列问题:
(1)该反应前后原子种类
(2)该反应使用催化剂的目的是
(3)参加反应的甲和生成的丙分子个数比为
(4)若反应中消耗14 g甲和9 g乙,则生成
(5)丙在生产生活中的一种用途是
请回答下列问题:
(1)该反应前后原子种类
没有(或无)
变化。(2)该反应使用催化剂的目的是
增大(或改变)
反应速率。(3)参加反应的甲和生成的丙分子个数比为
1:1
。(4)若反应中消耗14 g甲和9 g乙,则生成
22
g丙和1 g丁。(5)丙在生产生活中的一种用途是
灭火(或作气体肥料等)
。
答案:
14.
(1)没有(或无)
(2)增大(或改变)
(3)1:1
(4)22
(5)灭火(或作气体肥料等)
解析:本题考查微观示意图及质量守恒定律的应用。
(1)在化学反应前后,原子种类不变。
(2)催化剂可以改变化学反应的速率,该反应的目的是降低水煤气中CO的含量,因此反应速率越快,越有利于降低水煤气中CO的含量,因此该反应使用催化剂的目的是增大(或改变)反应速率。
(3)根据微观示意图可知,该反应的化学方程式为$CO + H₂O\stackrel{催化剂}{=\!=\!=}CO₂ + H₂,$则参加反应的甲和生成的丙分子个数比为1:1。
(4)根据质量守恒定律可知,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,若反应中消耗14g甲和9g乙,生成1g丁,则生成丙的质量为14g + 9g - 1g = 22g。
(5)丙是二氧化碳,二氧化碳可用于灭火、作气体肥料等。
(1)没有(或无)
(2)增大(或改变)
(3)1:1
(4)22
(5)灭火(或作气体肥料等)
解析:本题考查微观示意图及质量守恒定律的应用。
(1)在化学反应前后,原子种类不变。
(2)催化剂可以改变化学反应的速率,该反应的目的是降低水煤气中CO的含量,因此反应速率越快,越有利于降低水煤气中CO的含量,因此该反应使用催化剂的目的是增大(或改变)反应速率。
(3)根据微观示意图可知,该反应的化学方程式为$CO + H₂O\stackrel{催化剂}{=\!=\!=}CO₂ + H₂,$则参加反应的甲和生成的丙分子个数比为1:1。
(4)根据质量守恒定律可知,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,若反应中消耗14g甲和9g乙,生成1g丁,则生成丙的质量为14g + 9g - 1g = 22g。
(5)丙是二氧化碳,二氧化碳可用于灭火、作气体肥料等。
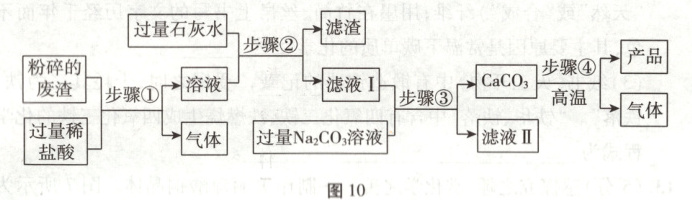
15. (5分)高纯氧化钙是一种重要的化工原料。图10所示为小组同学以某工厂废渣(主要成分为CaCO₃,含少量Fe₂O₃和MgCO₃)为原料,在实验室制备高纯氧化钙的实验方案。
请回答下列问题:
(1)氧化钙的化学式为
(2)将废渣粉碎为细小颗粒的目的是
(3)步骤②中过滤时玻璃棒的作用是
(4)步骤③中反应的化学方程式为
(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量
请回答下列问题:
(1)氧化钙的化学式为
CaO
。(2)将废渣粉碎为细小颗粒的目的是
增大反应物之间的接触面积,提高反应速率
。(3)步骤②中过滤时玻璃棒的作用是
引流
。(4)步骤③中反应的化学方程式为
CaCl₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaCl[或Ca(OH)₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaOH]
(写一个即可)。(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量
降低
(填“提高”“不变”或“降低”)。
答案:
15.
(1)CaO
(2)增大反应物之间的接触面积,提高反应速率
(3)引流
(4)CaCl₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaCl[或Ca(OH)₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaOH]
(5)降低
解析:本题考查化学工艺流程图。
(1)氧化钙的化学式为CaO。
(2)将废渣粉碎为细小颗粒的目的是增大反应物之间的接触面积,提高反应速率。
(3)过滤时玻璃棒的作用是引流。
(4)废渣主要成分为CaCO₃,含少量Fe₂O₃和MgCO₃,废渣中加入过量稀盐酸,发生反应CaCO₃ + 2HCl=\!=\!=CaCl₂ + CO₂↑ + H₂O、Fe₂O₃ + 6HCl=\!=\!=2FeCl₃ + 3H₂O、MgCO₃ + 2HCl=\!=\!=MgCl₂ + H₂O + CO₂↑,则步骤①后溶液中的溶质为CaCl₂、FeCl₃、MgCl₂、HCl,加入过量的石灰水(氢氧化钙溶液),CaCl₂不发生反应,剩下三种溶质与氢氧化钙发生反应2FeCl₃ + 3Ca(OH)₂=\!=\!=2Fe(OH)₃↓ + 3CaCl₂、Ca(OH)₂ + MgCl₂=\!=\!=Mg(OH)₂↓ + CaCl₂、Ca(OH)₂ + 2HCl=\!=\!=CaCl₂ + 2H₂O,所以步骤②后,滤液I中的溶质为CaCl₂和Ca(OH)₂,向滤液I中加入过量Na₂CO₃溶液,发生反应CaCl₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaCl、Ca(OH)₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaOH。
(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,结合
(4)中分析,则步骤②中不会有CaCl₂生成,且滤液I中过量的NaOH也不会与Na₂CO₃反应生成CaCO₃,即步骤③后得到CaCO₃的质量会减少,会使产品氧化钙的产量降低。
(1)CaO
(2)增大反应物之间的接触面积,提高反应速率
(3)引流
(4)CaCl₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaCl[或Ca(OH)₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaOH]
(5)降低
解析:本题考查化学工艺流程图。
(1)氧化钙的化学式为CaO。
(2)将废渣粉碎为细小颗粒的目的是增大反应物之间的接触面积,提高反应速率。
(3)过滤时玻璃棒的作用是引流。
(4)废渣主要成分为CaCO₃,含少量Fe₂O₃和MgCO₃,废渣中加入过量稀盐酸,发生反应CaCO₃ + 2HCl=\!=\!=CaCl₂ + CO₂↑ + H₂O、Fe₂O₃ + 6HCl=\!=\!=2FeCl₃ + 3H₂O、MgCO₃ + 2HCl=\!=\!=MgCl₂ + H₂O + CO₂↑,则步骤①后溶液中的溶质为CaCl₂、FeCl₃、MgCl₂、HCl,加入过量的石灰水(氢氧化钙溶液),CaCl₂不发生反应,剩下三种溶质与氢氧化钙发生反应2FeCl₃ + 3Ca(OH)₂=\!=\!=2Fe(OH)₃↓ + 3CaCl₂、Ca(OH)₂ + MgCl₂=\!=\!=Mg(OH)₂↓ + CaCl₂、Ca(OH)₂ + 2HCl=\!=\!=CaCl₂ + 2H₂O,所以步骤②后,滤液I中的溶质为CaCl₂和Ca(OH)₂,向滤液I中加入过量Na₂CO₃溶液,发生反应CaCl₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaCl、Ca(OH)₂ + Na₂CO₃=\!=\!=CaCO₃↓ + 2NaOH。
(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,结合
(4)中分析,则步骤②中不会有CaCl₂生成,且滤液I中过量的NaOH也不会与Na₂CO₃反应生成CaCO₃,即步骤③后得到CaCO₃的质量会减少,会使产品氧化钙的产量降低。
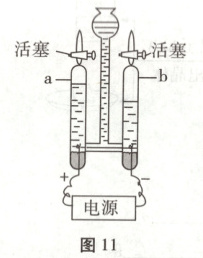
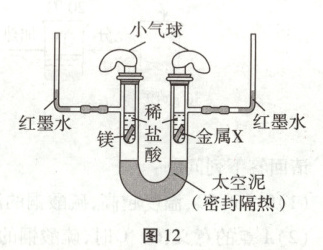
16. (5分)根据图11、图12所示实验回答问题。
(1)图11所示为验证水的组成及变化的实验。在电解器玻璃管中加满水,通电一段时间后,关闭电源。经检验,a中气体为氧气,b中气体为氢气;点燃b中氢气,在火焰上方罩一个干燥的烧杯,烧杯内壁出现
(2)图12所示为探究镁和X金属活动性强弱、金属与酸反应吸放热情况的实验。①反应前打磨金属的目的是
(1)图11所示为验证水的组成及变化的实验。在电解器玻璃管中加满水,通电一段时间后,关闭电源。经检验,a中气体为氧气,b中气体为氢气;点燃b中氢气,在火焰上方罩一个干燥的烧杯,烧杯内壁出现
水雾(或水珠)
。由此表明水是由H、O(或O、H)
(填元素符号)两种元素组成的。(2)图12所示为探究镁和X金属活动性强弱、金属与酸反应吸放热情况的实验。①反应前打磨金属的目的是
去除金属表面的氧化膜
;②左侧有气泡,右侧无气泡,说明镁的金属活动性比X强
;③得出镁和稀盐酸反应放热,依据的现象:一是左侧小气球先胀大后轻微缩小,二是左侧红墨水先上升,后下降至原位置
。

答案:
16.
(1)水雾(或水珠) H、O(或O、H)
(2)①去除金属表面的氧化膜 ②强 ③左侧红墨水先上升,后下降至原位置
解析:本题考查验证水的组成及变化的实验,探究金属活动性顺序的实验、金属与酸反应的实验。
(1)氢气燃烧生成水,点燃b中氢气,在火焰上方罩一个干燥的烧杯,烧杯内壁会出现水雾;电解水生成氢气和氧气,氢气燃烧生成水,由此表明水是由H、O两种元素组成的。
(2)①反应前打磨金属的目的是去除金属表面的氧化膜;②左侧有气泡,右侧无气泡,说明镁的金属活动性位于H之前,X的金属活动性位于H之后,说明镁的金属活动性比X强;③得出镁和稀盐酸反应放热,依据的现象:一是左侧小气球先胀大后轻微缩小,二是左侧红墨水先上升,后下降至原位置。
(1)水雾(或水珠) H、O(或O、H)
(2)①去除金属表面的氧化膜 ②强 ③左侧红墨水先上升,后下降至原位置
解析:本题考查验证水的组成及变化的实验,探究金属活动性顺序的实验、金属与酸反应的实验。
(1)氢气燃烧生成水,点燃b中氢气,在火焰上方罩一个干燥的烧杯,烧杯内壁会出现水雾;电解水生成氢气和氧气,氢气燃烧生成水,由此表明水是由H、O两种元素组成的。
(2)①反应前打磨金属的目的是去除金属表面的氧化膜;②左侧有气泡,右侧无气泡,说明镁的金属活动性位于H之前,X的金属活动性位于H之后,说明镁的金属活动性比X强;③得出镁和稀盐酸反应放热,依据的现象:一是左侧小气球先胀大后轻微缩小,二是左侧红墨水先上升,后下降至原位置。
查看更多完整答案,请扫码查看


