2025年初高衔接一本通化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年初高衔接一本通化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第85页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
1. (2025·黑龙江鹤岗宝泉岭高级中学月考)向一定量的$Fe$、$FeO$、$Fe_2O_3$的混合物中,加入$100\ mL\ 2\ mol·L^{-1}$的盐酸,恰好使混合物完全溶解,放出$112\ mL$(标准状况)的气体,所得溶液加入$KSCN$溶液无血红色出现。若用足量的$CO$在高温下还原相同质量的此混合物,能得到铁的质量为()
A.$2.8\ g$
B.$3.7\ g$
C.$5.6\ g$
D.$11.2\ g$
A.$2.8\ g$
B.$3.7\ g$
C.$5.6\ g$
D.$11.2\ g$
答案:
1.C 详解:向一定量的Fe、FeO、Fe₂O₃的混合物中加入100mL2mol·L⁻¹的盐酸,恰好使混合物完全溶解,所得溶液中加入KSCN溶液后无血红色出现,说明溶质为FeCl₂,根据氯元素守恒,n(FeCl₂)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.1L×2mol·L⁻¹=0.1mol,若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是0.1mol×56g·mol⁻¹=5.6g,C正确。
2. (2025·四川内江第一中学期中)已知反应:$4FeS_2 + 11O_2\overset{高温}{=}2Fe_2O_3 + 8SO_2$,$N_{A}$为阿伏加德罗常数的值,若消耗$96\ g\ FeS_2$,下列叙述错误的是()
A.转移的电子数为$8.8N_{A}$
B.消耗的氧化剂分子数为$2.2N_{A}$
C.氧化产物的物质的量共$1.6\ mol$
D.生成$SO_2$的体积为$35.84\ L$(标准状况)
A.转移的电子数为$8.8N_{A}$
B.消耗的氧化剂分子数为$2.2N_{A}$
C.氧化产物的物质的量共$1.6\ mol$
D.生成$SO_2$的体积为$35.84\ L$(标准状况)
答案:
2.C 详解:96gFeS₂的物质的量n(FeS₂)=0.8mol,根据反应方程式可知:反应每消耗4molFeS₂,反应过程中会消耗11molO₂,反应产生2molFe₂O₃和8molSO₂,反应过程中转移44mol电子。根据分析可知,若消耗96gFeS₂,反应中转移的电子的物质的量n(e⁻)=$\frac{0.8mol×44mol}{4mol}$=8.8mol,则转移电子数目是8.8N_A,A正确;在该反应中,FeS₂为还原剂,O₂为氧化剂,反应消耗0.8molFeS₂,则消耗O₂的物质的量n(O₂)=$\frac{0.8mol×11}{4}$=2.2mol,消耗的氧化剂分子数为2.2N_A,B正确;Fe₂O₃、SO₂既是氧化产物也是还原产物,根据方程式可知:反应消耗0.8molFeS₂时生成0.4molFe₂O₃和1.6molSO₂,则产生的氧化产物的物质的量为0.4mol+1.6mol=2mol,C错误;根据化学方程式的计量系数,消耗n(FeS₂)=0.8mol,生成二氧化硫1.6mol,在标准状况下,其体积为1.6mol×22.4L·mol⁻¹=35.84L,D正确。
3. (2025·上海中学期中)一定质量的铁的氧化物与$60\ mL\ 4\ mol·L^{-1}$的盐酸恰好完全反应,所得溶液中的$Fe^{2+}$恰好能被标准状况下$672\ mL\ Cl_2$氧化,则该固体中铁原子和氧原子的个数之比为()
A.$7:9$
B.$5:6$
C.$3:4$
D.$2:3$
A.$7:9$
B.$5:6$
C.$3:4$
D.$2:3$
答案:
3.B 详解:铁的氧化物与盐酸反应生成盐和水,由元素守恒可知,n(H₂O)=$\frac{1}{2}$n(HCl)=n(铁的氧化物中O),n(HCl)=4mol·L⁻¹×0.060L=0.24mol,则n(铁的氧化物中O)=0.12mol,Fe²⁺能恰好被标准状况下672mL氯气氧化,由电子守恒可知,n(Fe²⁺)=2n(Cl₂)=2×$\frac{0.672L}{22.4L·mol^{-1}}$=0.06mol,铁的氧化物中各元素正负化合价的代数和为0,设n(Fe³⁺)=x,则3x+0.06mol×2=0.12mol×2,解得x=0.04mol,该固体中铁原子和氧原子的个数之比为(0.06mol+0.04mol):0.12mol=5:6,B正确。
4. (2025·河北石家庄实验中学月考)向含$Fe^{2+}$、$I^{-}$、$Br^{-}$的溶液中通入过量的$Cl_2$,溶液中四种粒子的物质的量变化如下图所示,已知$b - a = 5$,线段Ⅳ表示一种含氧酸根离子的变化情况,且Ⅰ和Ⅳ表示的离子中含有相同的元素。下列说法错误的是()
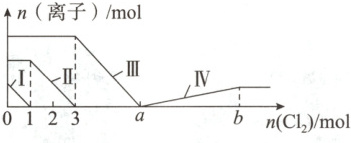
A.原溶液中$n(FeBr_2):n(FeI_2)=3:1$
B.线段Ⅱ表示$Fe^{2+}$的变化情况
C.线段Ⅳ表示$IO_3^{-}$的变化情况
D.根据图像可计算出$a = 5$,$b = 10$

A.原溶液中$n(FeBr_2):n(FeI_2)=3:1$
B.线段Ⅱ表示$Fe^{2+}$的变化情况
C.线段Ⅳ表示$IO_3^{-}$的变化情况
D.根据图像可计算出$a = 5$,$b = 10$
答案:
4.D 详解:向含Fe²⁺、I⁻、Br⁻的溶液中通入过量氯气,还原性I⁻>Fe²⁺>Br⁻,依次发生反应2I⁻+Cl₂=I₂+2Cl⁻、2Fe²⁺+Cl₂=2Fe³⁺+2Cl⁻、2Br⁻+Cl₂=Br₂+2Cl⁻,故线段I代表I⁻的变化情况,线段II代表Fe²⁺的变化情况,线段III代表Br⁻的变化情况。根据离子方程式和图像可知溶液中n(I⁻)=2n(Cl₂)=2mol,n(Fe²⁺)=2n(Cl₂)=2×(3mol-1mol)=4mol,根据电荷守恒可知n(I⁻)+n(Br⁻)=2n(Fe²⁺),故n(Br⁻)=2×4mol-2mol=6mol。由上述分析可知n(FeBr₂):n(FeI₂)=n(Br⁻):n(I⁻)=6mol:2mol=3:1,A正确;由上述分析可知,线段II代表Fe²⁺的变化情况,B正确;线段IV表示一种含氧酸根离子,且I和IV表示的物质中含有相同的元素,该元素为I元素,则a点后发生氯气氧化碘单质的反应,已知碘单质的物质的量为1mol,b-a=5,则反应消耗氯气的物质的量为5mol,根据得失电子守恒,则该含氧酸根离子中碘元素的化合价为+5价,则线段IV可表示IO₃⁻的变化情况,C正确;由上述分析可知,溶液中n(Br⁻)=6mol,根据2Br⁻+Cl₂=Br₂+2Cl⁻可知,溴离子反应需要氯气的物质的量为3mol,a=3+3=6,又因为b-a=5,所以b=a+5=6+5=11,D错误。
5. (2025·山西太原实验中学开学考)取一定量铜粉、铁粉的混合物,加入过量稀硫酸完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显$+2$价)。固体质量与各步实验的时间关系如图。
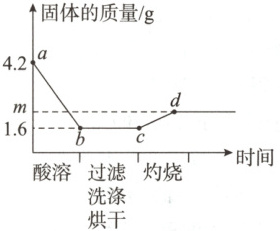
(1)$b$点时溶液中溶质的化学式为。
(2)原粉状混合物中铁粉的质量为$g$。
(3)$m$的值为。

(1)$b$点时溶液中溶质的化学式为。
(2)原粉状混合物中铁粉的质量为$g$。
(3)$m$的值为。
答案:
5.
(1)FeSO₄、H₂SO₄
(2)2.6
(3)2
详解:在金属活动性顺序表中,铁位于氢前面,可以和稀硫酸反应生成硫酸亚铁和氢气;铜位于氢后面,不能和稀硫酸反应。由题图可知,b点时铁全部反应。
(1)由于铁粉与过量的稀硫酸反应生成了硫酸亚铁和氢气,所以b点时溶液中溶质的化学式为FeSO₄、H₂SO₄。
(2)由题图可知,铜的质量为1.6g,原粉状混合物中铁粉的质量为4.2g-1.6g=2.6g。
(3)c点时固体还未与氧气反应,则固体只有铜,d点之后固体质量不变,则d点铜完全反应,只有氧化铜,发生反应的化学方程式为2Cu+O₂$\stackrel{\triangle}{=}$2CuO,$\frac{2Cu}{128}$~$\frac{2CuO}{160}$,$\frac{128}{1.6g}$=$\frac{160}{mg}$,解得m=2。
(1)FeSO₄、H₂SO₄
(2)2.6
(3)2
详解:在金属活动性顺序表中,铁位于氢前面,可以和稀硫酸反应生成硫酸亚铁和氢气;铜位于氢后面,不能和稀硫酸反应。由题图可知,b点时铁全部反应。
(1)由于铁粉与过量的稀硫酸反应生成了硫酸亚铁和氢气,所以b点时溶液中溶质的化学式为FeSO₄、H₂SO₄。
(2)由题图可知,铜的质量为1.6g,原粉状混合物中铁粉的质量为4.2g-1.6g=2.6g。
(3)c点时固体还未与氧气反应,则固体只有铜,d点之后固体质量不变,则d点铜完全反应,只有氧化铜,发生反应的化学方程式为2Cu+O₂$\stackrel{\triangle}{=}$2CuO,$\frac{2Cu}{128}$~$\frac{2CuO}{160}$,$\frac{128}{1.6g}$=$\frac{160}{mg}$,解得m=2。
6. (2025·上海复旦大学附属中学期中)已知$PCl_3$和$PCl_5$能发生如下水解反应:$PCl_3 + 3H_2O = H_3PO_3 + 3HCl$;$PCl_5 + 4H_2O = H_3PO_4 + 5HCl$。现将一定量的$PCl_3$和$PCl_5$混合物溶于足量水中,在加热条件下缓缓通入$0.020\ mol\ O_2$,恰好将$H_3PO_3$氧化为$H_3PO_4$($2H_3PO_3 + O_2 = 2H_3PO_4$)。往反应后的溶液中加入$15.725\ g\ Ca(OH)_2$,充分反应后磷元素全部转化为$Ca_3(PO_4)_2$沉淀,过滤后得到$2.5\ L$滤液,测得$c(OH^{-}) = 0.01\ mol·L^{-1}$。计算:
(1)所得$Ca_3(PO_4)_2$($M = 310\ g·mol^{-1}$)沉淀的质量。
(2)滤液中各溶质的物质的量浓度______。
(1)所得$Ca_3(PO_4)_2$($M = 310\ g·mol^{-1}$)沉淀的质量。
(2)滤液中各溶质的物质的量浓度______。
答案:
6.
(1)9.30g
(2)滤液中各溶质的物质的量浓度。
详解:
(1)加入15.725gCa(OH)₂,其物质的量为$\frac{15.725g}{74g·mol^{-1}}$=0.2125mol;过滤后得到2.5L滤液,测得c(OH⁻)=0.01mol·L⁻¹,剩余Ca(OH)₂的物质的量为$\frac{0.01mol·L^{-1}×2.5L}{2}$=0.0125mol,则与H₃PO₄、HCl反应的Ca(OH)₂的物质的量为0.2125mol-0.0125mol=0.2000mol。通入0.020molO₂,由反应2H₃PO₃+O₂=2H₃PO₄可得出由H₃PO₃转化生成的H₃PO₄的物质的量为0.040mol,n(H₃PO₃)=0.040mol。设原溶液中n(H₃PO₄)=xmol,由H₃PO₃~3HCl、H₃PO₄~5HCl,可求出生成HCl的物质的量为(0.040×3+5x)mol,依据酸碱中和反应,可得出:(0.040×3+5x)+(0.04+x)×3=0.2000×2,x=0.020。反应后,P元素全部转化为Ca₃(PO₄)₂,n[Ca₃(PO₄)₂]=$\frac{0.040+0.020}{2}$mol=0.030mol,m[Ca₃(PO₄)₂]=0.030mol×310g·mol⁻¹=9.30g,即所得Ca₃(PO₄)₂沉淀的质量为9.30g。
(2)反应后,P元素全部转化为Ca₃(PO₄)₂沉淀,Ca(OH)₂过量,HCl全部转化为CaCl₂。过滤后得到2.5L滤液,测得c(OH⁻)=0.01mol·L⁻¹,则c[Ca(OH)₂]=$\frac{0.01mol·L^{-1}}{2}$=0.005mol·L⁻¹,c(CaCl₂)=$\frac{0.040×3+5x}{2.5L}$=$\frac{0.11mol}{2.5L}$=0.044mol·L⁻¹。
所以原溶液中所含Ca(OH)₂的物质的量浓度为0.005mol·L⁻¹,CaCl₂的物质的量浓度为0.044mol·L⁻¹。
(1)9.30g
(2)滤液中各溶质的物质的量浓度。
详解:
(1)加入15.725gCa(OH)₂,其物质的量为$\frac{15.725g}{74g·mol^{-1}}$=0.2125mol;过滤后得到2.5L滤液,测得c(OH⁻)=0.01mol·L⁻¹,剩余Ca(OH)₂的物质的量为$\frac{0.01mol·L^{-1}×2.5L}{2}$=0.0125mol,则与H₃PO₄、HCl反应的Ca(OH)₂的物质的量为0.2125mol-0.0125mol=0.2000mol。通入0.020molO₂,由反应2H₃PO₃+O₂=2H₃PO₄可得出由H₃PO₃转化生成的H₃PO₄的物质的量为0.040mol,n(H₃PO₃)=0.040mol。设原溶液中n(H₃PO₄)=xmol,由H₃PO₃~3HCl、H₃PO₄~5HCl,可求出生成HCl的物质的量为(0.040×3+5x)mol,依据酸碱中和反应,可得出:(0.040×3+5x)+(0.04+x)×3=0.2000×2,x=0.020。反应后,P元素全部转化为Ca₃(PO₄)₂,n[Ca₃(PO₄)₂]=$\frac{0.040+0.020}{2}$mol=0.030mol,m[Ca₃(PO₄)₂]=0.030mol×310g·mol⁻¹=9.30g,即所得Ca₃(PO₄)₂沉淀的质量为9.30g。
(2)反应后,P元素全部转化为Ca₃(PO₄)₂沉淀,Ca(OH)₂过量,HCl全部转化为CaCl₂。过滤后得到2.5L滤液,测得c(OH⁻)=0.01mol·L⁻¹,则c[Ca(OH)₂]=$\frac{0.01mol·L^{-1}}{2}$=0.005mol·L⁻¹,c(CaCl₂)=$\frac{0.040×3+5x}{2.5L}$=$\frac{0.11mol}{2.5L}$=0.044mol·L⁻¹。
所以原溶液中所含Ca(OH)₂的物质的量浓度为0.005mol·L⁻¹,CaCl₂的物质的量浓度为0.044mol·L⁻¹。
查看更多完整答案,请扫码查看


