2025年初高衔接一本通化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年初高衔接一本通化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第80页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
1. (2025·上海浦东中学期中)迄今为止人类冶炼最多的金属是(
A.铝
B.铜
C.铁
D.金
C
)A.铝
B.铜
C.铁
D.金
答案:
1.C 详解:铁是目前使用量最大的金属,故人类冶炼最多的金属是铁,C符合题意。
2. (2025·湖南张家界联考)下列关于铝及其化合物的说法不正确的是(
A.Al既可用于食品包装,也可用作建筑材料
B.Al₂O₃既可用来冶炼金属Al,也可用作耐火材料
C.明矾[KAl(SO₄)₂·12H₂O]有强氧化性,可用作消毒剂
D.Al(OH)₃既可用作治疗胃酸过多的药物,也可用来制备一些铝盐
C
)A.Al既可用于食品包装,也可用作建筑材料
B.Al₂O₃既可用来冶炼金属Al,也可用作耐火材料
C.明矾[KAl(SO₄)₂·12H₂O]有强氧化性,可用作消毒剂
D.Al(OH)₃既可用作治疗胃酸过多的药物,也可用来制备一些铝盐
答案:
2.C 详解:金属铝具有良好的延展性,因此铝可以制成铝箔用于食品包装,铝合金密度小、强度大,金属铝也可用作建筑材料,A正确;电解熔融的$\mathrm{Al}_2\mathrm{O}_3$可冶炼金属$\mathrm{Al}$,由于$\mathrm{Al}_2\mathrm{O}_3$具有耐高温的性质,可用作耐火材料,B正确;明矾$[\mathrm{KAl(SO}_4\mathrm{)_2· 12H}_2\mathrm{O]}$溶于水后,生成有吸附作用的$\mathrm{Al(OH)}_3$胶体,可用作净水剂,但$\mathrm{Al(OH)}_3$并不具有消毒作用,C错误;$\mathrm{Al(OH)}_3$与胃酸中的盐酸反应生成氯化铝和水,可用作治疗胃酸过多的药物,也可用来制备铝盐,D正确。
3. (2025·陕西西安月考)将12.6g镁铝合金的粉末加入过量盐酸中,得到标准状况下13.44L H₂,下列说法正确的是(
A.合金中铝的质量分数为40%
B.将该合金投入过量的氢氧化钠溶液中,产生标准状况下10.08L H₂
C.合金中镁的物质的量为0.3mol
D.合金中镁与铝的物质的量之比为1 : 1
C
)A.合金中铝的质量分数为40%
B.将该合金投入过量的氢氧化钠溶液中,产生标准状况下10.08L H₂
C.合金中镁的物质的量为0.3mol
D.合金中镁与铝的物质的量之比为1 : 1
答案:
3.C 详解:将$12.6\mathrm{g}$镁铝合金的粉末放入过量的盐酸中,分别发生反应$\mathrm{Mg}+2\mathrm{H}^+=\mathrm{Mg}^{2+}+\mathrm{H}_2\uparrow$、$2\mathrm{Al}+6\mathrm{H}^+=2\mathrm{Al}^{3+}+3\mathrm{H}_2\uparrow$,假设$\mathrm{Mg}$和$\mathrm{Al}$物质的量分别为$x\mathrm{mol}$、$y\mathrm{mol}$,则$(x+\frac{3}{2}y)×22.4=13.44$,$24x+27y=12.6$,联立两式,解得$x=0.3$、$y=0.2$。根据分析可知,合金中铝的质量为$0.2\mathrm{mol}×27\mathrm{g· mol}^{-1}=5.4\mathrm{g}$,其质量分数为$\frac{5.7\mathrm{g}}{12.6\mathrm{g}}×100\%\approx42.9\%$,A错误;将该合金投入过量的氢氧化钠溶液中,只有铝单质能与氢氧化钠反应生成氢气,$0.2\mathrm{mol}\mathrm{Al}$与氢氧化钠发生反应生成氢气的物质的量为$0.3\mathrm{mol}$,体积为$0.3\mathrm{mol}×22.4\mathrm{L· mol}^{-1}=6.72\mathrm{L}$,B错误;根据分析可知,合金中镁的物质的量为$0.3\mathrm{mol}$,C正确;根据分析可知,合金中镁与铝的物质的量之比为$3:2$,D错误。
4. (2025·广东江门培英高级中学月考)把一小块镁铝合金溶于100mL盐酸中,然后向其中逐滴加入1mol·L⁻¹ NaOH溶液,生成沉淀的质量和加入NaOH溶液体积的关系如图所示。已知:Al(OH)₃ + NaOH = Na[Al(OH)₄],Na[Al(OH)₄]溶于水。下列说法错误的是(
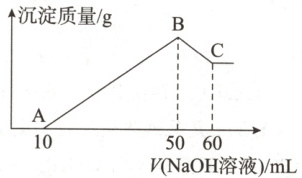
A.镁铝合金完全溶于盐酸时一共产生224mL H₂
B.盐酸的浓度为0.5mol·L⁻¹
C.反应至B点时,所得溶液中溶质仅有一种
D.A点之前未产生沉淀,说明镁铝合金已经完全溶解于盐酸中
A
)
A.镁铝合金完全溶于盐酸时一共产生224mL H₂
B.盐酸的浓度为0.5mol·L⁻¹
C.反应至B点时,所得溶液中溶质仅有一种
D.A点之前未产生沉淀,说明镁铝合金已经完全溶解于盐酸中
答案:
4.A 详解:由题图可知,从开始至加入$\mathrm{NaOH}$溶液$10\mathrm{mL}$,没有沉淀生成,说明原溶液中盐酸有剩余,此时发生的反应为$\mathrm{HCl}+\mathrm{NaOH}=\mathrm{NaCl}+\mathrm{H}_2\mathrm{O}$;继续滴加$\mathrm{NaOH}$溶液至$50\mathrm{mL}$时,沉淀量最大,此时沉淀为$\mathrm{Mg(OH)}_2$和$\mathrm{Al(OH)}_3$,溶液溶质为$\mathrm{NaCl}$;再继续滴加$\mathrm{NaOH}$溶液,发生反应$\mathrm{Al(OH)}_3+\mathrm{NaOH}=\mathrm{Na[Al(OH)}_4\mathrm{]}$,$\mathrm{Al(OH)}_3$溶解。加入$\mathrm{NaOH}$溶液为$50\mathrm{mL}$时,$\mathrm{AB}$段消耗$\mathrm{NaOH}$溶液$40\mathrm{mL}$,则根据元素守恒,$n(\mathrm{HCl})=n(\mathrm{NaCl})=1\mathrm{mol· L}^{-1}×0.04\mathrm{L}=0.04\mathrm{mol}$,则产生氢气的物质的量为$0.02\mathrm{mol}$,由于没有注明标准状况下,则氢气的体积无法计算,A错误;加入$\mathrm{NaOH}$溶液为$50\mathrm{mL}$时,沉淀为$\mathrm{Mg(OH)}_2$和$\mathrm{Al(OH)}_3$,溶液溶质为$\mathrm{NaCl}$,则根据元素守恒,$n(\mathrm{HCl})=n(\mathrm{NaCl})=1\mathrm{mol· L}^{-1}×0.05\mathrm{L}=0.05\mathrm{mol}$,因此盐酸的浓度为$0.5\mathrm{mol· L}^{-1}$,B正确;根据分析,滴加$\mathrm{NaOH}$溶液至$50\mathrm{mL}$时,沉淀量最大,此时沉淀为$\mathrm{Mg(OH)}_2$和$\mathrm{Al(OH)}_3$,溶液溶质为$\mathrm{NaCl}$,则所得溶液中溶质仅有一种,C正确;根据分析,A点之前未产生沉淀,则原溶液中盐酸有剩余,说明镁铝合金已经完全溶解于盐酸中,D正确。
5. (2025·河南濮阳第一高级中学期中)用铁、铝的混合物进行如图实验:
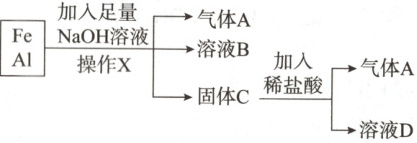
(1)加入过量NaOH溶液发生的离子反应方程式为
(2)铝在空气中表面形成的氧化膜很薄,为了适应不同用途,需将表面氧化膜碱洗除去再进行处理,请写出碱洗氧化膜的离子方程式
(3)某课外兴趣小组为探究某种铝合金(组成元素为Mg和Al)是否符合国家质量标准(国家规定铝合金中铝含量不能低于78%),设计如图装置在室温下进行实验。

反应前先第一次读取量气管液面刻度,待反应停止后,体系温度恢复到室温,第二次读取量气管液面刻度之前需要进行的一步操作是______。计算两次液面差,并将气体体积折算成标准状况下的体积,为V mL。若a = 0.039,V = 33.6,说明该合金______(填“符合”或“不符合”)国家标准。若将装置中的足量氢氧化钠溶液换为足量盐酸,则反应停止后量气管内气体体积(折算成标准状况下)为______mL。]

(1)加入过量NaOH溶液发生的离子反应方程式为
2Al + 2OH⁻ + 6H₂O = 2[Al(OH)₄]⁻ + 3H₂↑
,操作X的名称是过滤
。(2)铝在空气中表面形成的氧化膜很薄,为了适应不同用途,需将表面氧化膜碱洗除去再进行处理,请写出碱洗氧化膜的离子方程式
2OH⁻ + Al₂O₃ + 3H₂O = 2[Al(OH)₄]⁻
。(3)某课外兴趣小组为探究某种铝合金(组成元素为Mg和Al)是否符合国家质量标准(国家规定铝合金中铝含量不能低于78%),设计如图装置在室温下进行实验。

反应前先第一次读取量气管液面刻度,待反应停止后,体系温度恢复到室温,第二次读取量气管液面刻度之前需要进行的一步操作是______。计算两次液面差,并将气体体积折算成标准状况下的体积,为V mL。若a = 0.039,V = 33.6,说明该合金______(填“符合”或“不符合”)国家标准。若将装置中的足量氢氧化钠溶液换为足量盐酸,则反应停止后量气管内气体体积(折算成标准状况下)为______mL。]
答案:
5.
(1)$2\mathrm{Al}+2\mathrm{OH}^-+6\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-+3\mathrm{H}_2\uparrow$过滤
(2)$2\mathrm{OH}^-+\mathrm{Al}_2\mathrm{O}_3+3\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-$
(3)调节量气管和水准管的高度使两液面相平不符合$44.8$
详解:铁铝混合物加入足量氢氧化钠溶液,铝溶解,生成四羟基合铝酸钠和氢气,A为氢气,B为四羟基合铝酸钠溶液,铁不反应形成沉淀,C为铁,加入稀盐酸生成氢气和氯化亚铁,D为氯化亚铁。
(1)根据分析可知,铝和氢氧化钠反应生成四羟基合铝酸钠和氢气,离子方程式为$2\mathrm{Al}+2\mathrm{OH}^-+6\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-+3\mathrm{H}_2\uparrow$;操作X为过滤。
(3)根据题意,待反应停止后,体系温度恢复到室温,再调节量气管和水准管的高度,使两液面相平,读数时要眼睛与溶液凹液面相平,再读取数据。$n(\mathrm{H}_2)=\frac{0.0336\mathrm{L}}{22.4\mathrm{L· mol}^{-1}}=1.5×10^{-3}\mathrm{mol}$,根据$2\mathrm{Al}+2\mathrm{OH}^-+6\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-+3\mathrm{H}_2\uparrow$可知,$n(\mathrm{Al})=\frac{2}{3}n(\mathrm{H}_2)=1.0×10^{-3}\mathrm{mol}$,则$a\mathrm{g}$铝合金样品中,铝的质量为$27\mathrm{g· mol}^{-1}×1.0×10^{-3}\mathrm{mol}=0.027\mathrm{g}$,其质量分数为$\frac{0.027\mathrm{g}}{0.039\mathrm{g}}×100\%\approx69.2\%$,故该合金不合格。
由上述分析可知,铝的质量为$0.027\mathrm{g}$,物质的量为$1×10^{-3}\mathrm{mol}$,镁的质量为$0.012\mathrm{g}$,物质的量为$5×10^{-4}\mathrm{mol}$,根据$2\mathrm{Al}+6\mathrm{HCl}=2\mathrm{AlCl}_3+3\mathrm{H}_2\uparrow$和$\mathrm{Mg}+2\mathrm{HCl}=\mathrm{MgCl}_2+\mathrm{H}_2\uparrow$可知,$n(\mathrm{H}_2)=\frac{3}{2}×1×10^{-3}\mathrm{mol}+5×10^{-4}\mathrm{mol}=2.0×10^{-3}\mathrm{mol}$,标准状况下氢气的体积为$22.4\mathrm{L· mol}^{-1}×2.0×10^{-3}\mathrm{mol}=4.48×10^{-2}\mathrm{L}=44.8\mathrm{mL}$。
(1)$2\mathrm{Al}+2\mathrm{OH}^-+6\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-+3\mathrm{H}_2\uparrow$过滤
(2)$2\mathrm{OH}^-+\mathrm{Al}_2\mathrm{O}_3+3\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-$
(3)调节量气管和水准管的高度使两液面相平不符合$44.8$
详解:铁铝混合物加入足量氢氧化钠溶液,铝溶解,生成四羟基合铝酸钠和氢气,A为氢气,B为四羟基合铝酸钠溶液,铁不反应形成沉淀,C为铁,加入稀盐酸生成氢气和氯化亚铁,D为氯化亚铁。
(1)根据分析可知,铝和氢氧化钠反应生成四羟基合铝酸钠和氢气,离子方程式为$2\mathrm{Al}+2\mathrm{OH}^-+6\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-+3\mathrm{H}_2\uparrow$;操作X为过滤。
(3)根据题意,待反应停止后,体系温度恢复到室温,再调节量气管和水准管的高度,使两液面相平,读数时要眼睛与溶液凹液面相平,再读取数据。$n(\mathrm{H}_2)=\frac{0.0336\mathrm{L}}{22.4\mathrm{L· mol}^{-1}}=1.5×10^{-3}\mathrm{mol}$,根据$2\mathrm{Al}+2\mathrm{OH}^-+6\mathrm{H}_2\mathrm{O}=2[\mathrm{Al(OH)}_4]^-+3\mathrm{H}_2\uparrow$可知,$n(\mathrm{Al})=\frac{2}{3}n(\mathrm{H}_2)=1.0×10^{-3}\mathrm{mol}$,则$a\mathrm{g}$铝合金样品中,铝的质量为$27\mathrm{g· mol}^{-1}×1.0×10^{-3}\mathrm{mol}=0.027\mathrm{g}$,其质量分数为$\frac{0.027\mathrm{g}}{0.039\mathrm{g}}×100\%\approx69.2\%$,故该合金不合格。
由上述分析可知,铝的质量为$0.027\mathrm{g}$,物质的量为$1×10^{-3}\mathrm{mol}$,镁的质量为$0.012\mathrm{g}$,物质的量为$5×10^{-4}\mathrm{mol}$,根据$2\mathrm{Al}+6\mathrm{HCl}=2\mathrm{AlCl}_3+3\mathrm{H}_2\uparrow$和$\mathrm{Mg}+2\mathrm{HCl}=\mathrm{MgCl}_2+\mathrm{H}_2\uparrow$可知,$n(\mathrm{H}_2)=\frac{3}{2}×1×10^{-3}\mathrm{mol}+5×10^{-4}\mathrm{mol}=2.0×10^{-3}\mathrm{mol}$,标准状况下氢气的体积为$22.4\mathrm{L· mol}^{-1}×2.0×10^{-3}\mathrm{mol}=4.48×10^{-2}\mathrm{L}=44.8\mathrm{mL}$。
查看更多完整答案,请扫码查看


