2025年初高衔接一本通化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年初高衔接一本通化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
1. (2025·天津耀华中学月考)下列离子方程式正确的是(
A.硫酸氢钠溶液与NaOH溶液混合:${HSO^{-}_{4} + OH^{-} \xlongequal{} H_{2}O + SO^{2-}_{4}}$
B.氯化铝溶液与氨水反应:${Al^{3+} + 3OH^{-} \xlongequal{} Al(OH)_{3} \downarrow}$
C.氢氧化镁与稀硫酸反应:${H^{+} + OH^{-} \xlongequal{} H_{2}O}$
D.将少量澄清石灰水滴入${NaHCO_{3}}$溶液中,反应的离子方程式为${Ca^{2+} + 2OH^{-} + 2HCO^{-}_{3} \xlongequal{} CaCO_{3} \downarrow + CO^{2-}_{3} + 2H_{2}O}$
D
)A.硫酸氢钠溶液与NaOH溶液混合:${HSO^{-}_{4} + OH^{-} \xlongequal{} H_{2}O + SO^{2-}_{4}}$
B.氯化铝溶液与氨水反应:${Al^{3+} + 3OH^{-} \xlongequal{} Al(OH)_{3} \downarrow}$
C.氢氧化镁与稀硫酸反应:${H^{+} + OH^{-} \xlongequal{} H_{2}O}$
D.将少量澄清石灰水滴入${NaHCO_{3}}$溶液中,反应的离子方程式为${Ca^{2+} + 2OH^{-} + 2HCO^{-}_{3} \xlongequal{} CaCO_{3} \downarrow + CO^{2-}_{3} + 2H_{2}O}$
答案:
1. D 详解:硫酸氢钠在溶液中电离产生$Na^{+}$、$H^{+}$、$SO_{4}^{2-}$,与$NaOH$溶液混合,本质是$H^{+}$与$OH^{-}$反应,对应的离子方程式为$H^{+} + OH^{-} = H_{2}O$,A错误;氯化铝溶液中加入氨水,反应生成$Al(OH)_{3}$沉淀,对应的离子方程式为$Al^{3+} + 3NH_{3}· H_{2}O = Al(OH)_{3}\downarrow + 3NH_{4}^{+}$,B错误;氢氧化镁难溶于水,离子方程式中用化学式表示,C错误;少量的$Ca(OH)_{2}$和$NaHCO_{3}$溶液混合,氢氧化钙少量,完全反应,对应离子方程式为$2OH^{-} + Ca^{2+} + 2HCO_{3}^{-} = CaCO_{3}\downarrow + 2H_{2}O + CO_{3}^{2-}$,D正确。
2. (2024·四川成都期中)常温下,下列各组离子在指定条件下能大量共存的是(
A.无色透明的溶液中:${Fe^{2+}}$、${CH_{3}COO^{-}}$、${Na^{+}}$、${NO^{-}_{3}}$
B.使酚酞溶液变红的溶液:${Na^{+}}$、${OH^{-}}$、${SO^{2-}_{4}}$、${Cu^{2+}}$
C.可与锌反应放出氢气的溶液中:${K^{+}}$、${Ca^{2+}}$、${Cl^{-}}$、${HCO^{-}_{3}}$
D.在${pH > 7}$的溶液中:${Ba^{2+}}$、${Na^{+}}$、${NO^{-}_{3}}$、${Cl^{-}}$
D
)A.无色透明的溶液中:${Fe^{2+}}$、${CH_{3}COO^{-}}$、${Na^{+}}$、${NO^{-}_{3}}$
B.使酚酞溶液变红的溶液:${Na^{+}}$、${OH^{-}}$、${SO^{2-}_{4}}$、${Cu^{2+}}$
C.可与锌反应放出氢气的溶液中:${K^{+}}$、${Ca^{2+}}$、${Cl^{-}}$、${HCO^{-}_{3}}$
D.在${pH > 7}$的溶液中:${Ba^{2+}}$、${Na^{+}}$、${NO^{-}_{3}}$、${Cl^{-}}$
答案:
2. D 详解:亚铁离子在溶液中呈浅绿色,A不符合题意;铜离子与氢氧根离子反应生成氢氧化铜沉淀,不能大量共存,B不符合题意;可与锌反应放出氢气的溶液显酸性,碳酸氢根离子与氢离子反应生成二氧化碳和水,不能大量共存,C不符合题意;$pH>7$的溶液中$Ba^{2+}$、$Na^{+}$、$NO_{3}^{-}$、$Cl^{-}$可以大量共存,D符合题意。
3. (2024·河南郑州第四高级中学月考)图中相连物质间在一定条件下可以发生反应,下表提供的四组物质符合要求的是(
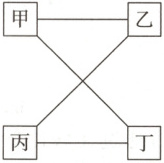
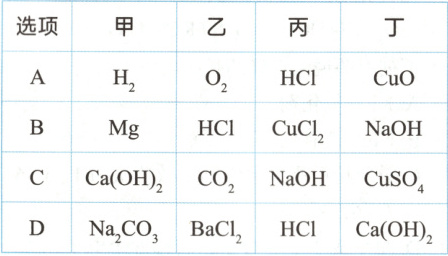
C
)

答案:
3. C 详解:氧气与氯化氢不反应,A不符合题意;镁与氢氧化钠不反应,$HCl$与氯化铜不反应,B不符合题意;氯化钡与盐酸不反应,D不符合题意。
4. (2024·浙江湖州月考)关于反应${4CO_{2} + SiH_{4} \xlongequal{高温} 4CO + 2H_{2}O + SiO_{2}}$,已知${SiH_{4}}$和${SiO_{2}}$中硅元素的化合价相同,下列说法正确的是(
A.${H_{2}O}$是氧化产物
B.${SiH_{4}}$发生还原反应
C.氧化剂与还原剂的分子个数之比为$1:4$
D.生成1个${H_{2}O}$时,转移2个电子
A
)A.${H_{2}O}$是氧化产物
B.${SiH_{4}}$发生还原反应
C.氧化剂与还原剂的分子个数之比为$1:4$
D.生成1个${H_{2}O}$时,转移2个电子
答案:
4. A 详解:根据反应$4CO + SiH_{4}\stackrel{高温}{=}4CO + 2H_{2}O + SiO_{2}$,反应中氢元素化合价由-1升高到+1,$SiH_{4}$为还原剂,故$H_{2}O$是氧化产物,A正确;$SiH_{4}$为还原剂,发生氧化反应,B错误;反应中$CO_{2}$是氧化剂,$SiH_{4}$是还原剂,氧化剂与还原剂的分子个数之比为4:1,C错误;氢元素化合价由-1升高到+1,生成1个$H_{2}O$时,转移4个电子,D错误。
5. (2025·广东广州实验学校月考)向一定体积的${Ba(OH)_{2}}$溶液中逐滴滴加稀硫酸,并通过数字传感器测得混合溶液的导电能力随时间变化的曲线如图所示。下列有关说法正确的是(
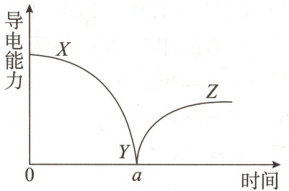
A.实验时用${NaOH}$代替${Ba(OH)_{2}}$也能得到该曲线
B.$YZ$段溶液的导电能力不断增大,主要是由于稀硫酸过量
C.$a$时刻溶液的导电能力接近为0,所以${BaSO_{4}}$是非电解质
D.该实验发生反应的离子方程式为${Ba^{2+} + OH^{-} + H^{+} + SO^{2-}_{4} \xlongequal{} BaSO_{4} \downarrow + H_{2}O}$
B
)
A.实验时用${NaOH}$代替${Ba(OH)_{2}}$也能得到该曲线
B.$YZ$段溶液的导电能力不断增大,主要是由于稀硫酸过量
C.$a$时刻溶液的导电能力接近为0,所以${BaSO_{4}}$是非电解质
D.该实验发生反应的离子方程式为${Ba^{2+} + OH^{-} + H^{+} + SO^{2-}_{4} \xlongequal{} BaSO_{4} \downarrow + H_{2}O}$
答案:
5. B 详解:$NaOH$与稀硫酸反应生成$Na_{2}SO_{4}$,$Na_{2}SO_{4}$溶于水完全电离,故不会出现溶液导电能力几乎为零的点,A错误;YZ段溶液的导电能力不断增大,表明随着稀硫酸的不断加入,溶液中离子浓度不断增大,主要是过量$H_{2}SO_{4}$电离引起的,B正确;XY段发生反应的离子方程式为$Ba^{2+} + 2OH^{-} + 2H^{+} + SO_{4}^{2-} = BaSO_{4}\downarrow + 2H_{2}O$,$BaSO_{4}$难溶于水,导致溶液中离子浓度减小,导电能力减弱,但$BaSO_{4}$是强电解质,C错误;该实验发生反应的离子方程式为$Ba^{2+} + 2OH^{-} + 2H^{+} + SO_{4}^{2-} = BaSO_{4}\downarrow + 2H_{2}O$,D错误。
6. (2024·湖北黄冈月考)用高铁酸钠(${Na_{2}FeO_{4}}$)对河水、湖水消毒是城市饮水处理的新技术。已知反应${Fe_{2}O_{3} + Na_{2}O_{2}}$ (氧为$-1$价)${\longrightarrow Na_{2}FeO_{4} + Na_{2}O}$(未配平),下列说法不正确的是(
A.${Na_{2}O_{2}}$既是氧化剂又是还原剂
B.${Fe_{2}O_{3}}$在反应中失去电子
C.配平后为${Fe_{2}O_{3} + 3Na_{2}O_{2} \xlongequal{} 2Na_{2}FeO_{4} + Na_{2}O}$
D.${Na_{2}FeO_{4}}$能杀菌消毒是因其具有强氧化性
A
)A.${Na_{2}O_{2}}$既是氧化剂又是还原剂
B.${Fe_{2}O_{3}}$在反应中失去电子
C.配平后为${Fe_{2}O_{3} + 3Na_{2}O_{2} \xlongequal{} 2Na_{2}FeO_{4} + Na_{2}O}$
D.${Na_{2}FeO_{4}}$能杀菌消毒是因其具有强氧化性
答案:
6. A 详解:在反应$Fe_{2}O_{3} + Na_{2}O_{2}$(氧为-1价)$\longrightarrow Na_{2}FeO_{4} + Na_{2}O$中,$Fe_{2}O_{3}$中的铁元素失电子被氧化,化合价由+3升高到+6,故$Fe_{2}O_{3}$是还原剂,$Na_{2}O_{2}$中氧元素得电子被还原,化合价由-1降低到-2,故$Na_{2}O_{2}$是氧化剂,A错误、B正确;根据得失电子守恒和原子守恒配平为$Fe_{2}O_{3} + 3Na_{2}O_{2} = 2Na_{2}FeO_{4} + Na_{2}O$,C正确;$Na_{2}FeO_{4}$中铁元素处于高价态,具有强氧化性,所以能用于自来水的杀菌消毒,D正确。
查看更多完整答案,请扫码查看


