2025年初高衔接一本通化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年初高衔接一本通化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
4. (2024·浙江杭州学军中学期末)配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是(
A.配制$480 mL 0.10 mol · L^{-1}$的$CuSO_4$溶液,需称取$12.5 g$胆矾($CuSO_4 · 5H_2O$)
B.配制$1 L 0.1 mol · L^{-1}$的$NaCl$溶液时,用托盘天平称量$5.85 g NaCl$固体
C.配制一定物质的量浓度的溶液,定容时仰视刻度线会导致所配溶液浓度偏高
D.用浓盐酸配制稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏低
A
)A.配制$480 mL 0.10 mol · L^{-1}$的$CuSO_4$溶液,需称取$12.5 g$胆矾($CuSO_4 · 5H_2O$)
B.配制$1 L 0.1 mol · L^{-1}$的$NaCl$溶液时,用托盘天平称量$5.85 g NaCl$固体
C.配制一定物质的量浓度的溶液,定容时仰视刻度线会导致所配溶液浓度偏高
D.用浓盐酸配制稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏低
答案:
4.A 详解:实验室中没有480mL的容量瓶,所以应配制500mL溶液,需称取胆矾的质量为0.10mol·L⁻¹×0.5L×250g·mol⁻¹=12.5g,A正确;托盘天平的精确度是0.1g,不能用托盘天平称量5.85g NaCl固体,B错误;配制一定物质的量浓度的溶液,定容时仰视刻度线会使溶液体积偏大,导致所配溶液浓度偏低,C错误;用浓盐酸配制稀盐酸,量取浓盐酸时仰视量筒的刻度线,会使浓盐酸的体积偏大,导致所配溶液浓度偏高,D错误。
5. (2025·江苏苏州田家炳实验高级中学月考)配制一定体积一定物质的量浓度的$Na_2CO_3$溶液的操作过程示意图如下所示。

下列说法中不正确的是(
A.“操作1”将$Na_2CO_3$在烧杯中溶解并冷却至室温
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时若俯视刻度线会造成所配溶液浓度偏低
D.所配制的$Na_2CO_3$溶液中$c(Na^+)$为$2 mol · L^{-1}$

下列说法中不正确的是(
C
)A.“操作1”将$Na_2CO_3$在烧杯中溶解并冷却至室温
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时若俯视刻度线会造成所配溶液浓度偏低
D.所配制的$Na_2CO_3$溶液中$c(Na^+)$为$2 mol · L^{-1}$
答案:
5.C 详解:溶解需要在烧杯中进行,冷却至室温后再转移到容量瓶中,A正确;向容量瓶中转移溶液时用玻璃棒引流,B正确;定容时若俯视刻度线,溶液体积偏小,造成所配溶液浓度偏大,C错误;碳酸钠的质量为10.6g,物质的量为0.1mol,容量瓶规格为100mL,溶液中溶质的物质的量浓度为$\frac{0.1mol}{0.1L}=1mol·L⁻¹,$则钠离子浓度为1mol·L⁻¹×2=2mol·L⁻¹,D正确。
6. (2025·陕西西安华清中学月考)实验室需要$0.2 mol · L^{-1} NaOH$溶液$480 mL$和$0.5 mol · L^{-1}$硫酸溶液$500 mL$。根据这两种溶液的配制情况回答下列问题:
(1)用如图所示的仪器中配制溶液肯定不需要的是
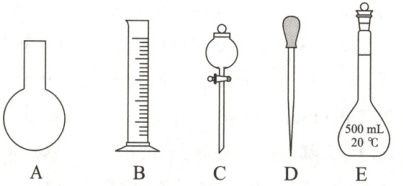
(2)下列有关容量瓶使用方法的操作中,错误的是
A. 使用容量瓶之前应检查它是否漏水
B. 容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D. 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E. 盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀
(3)在配制$NaOH$溶液时:
①根据计算,用托盘天平称取$NaOH$的质量为
②若$NaOH$溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度
③若$NaOH$固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度
(1)用如图所示的仪器中配制溶液肯定不需要的是
AC
(填字母),配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒
(填仪器名称)。
(2)下列有关容量瓶使用方法的操作中,错误的是
BCD
(填字母)。A. 使用容量瓶之前应检查它是否漏水
B. 容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D. 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E. 盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀
(3)在配制$NaOH$溶液时:
①根据计算,用托盘天平称取$NaOH$的质量为
4.0
$g$。②若$NaOH$溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度
<
(填“>”“<”或“=”,下同)$0.2 mol · L^{-1}$。③若$NaOH$固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度
>
$0.2 mol · L^{-1}$。
答案:
6.(1)AC 烧杯、玻璃棒 (2)BCD
(3)①4.0 ②< ③>
详解:(1)配制0.2mol·L⁻¹NaOH溶液480mL和0.5mol·L⁻¹硫酸溶液500mL,需要使用500mL的容量瓶配制溶液。用量筒量取水,在烧杯中进行物质的溶解;为促进溶质的溶解,要使用玻璃棒进行搅拌;在转移溶液时要使用玻璃棒引流;最后定容时要使用胶头滴管,不需要使用烧瓶和分液漏斗,故不需使用的仪器序号是AC。配制溶液还需使用的玻璃仪器有烧杯、玻璃棒。
(2)容量瓶是准确配制一定体积、一定物质的量浓度的溶液的仪器。由于溶液具有均一性、稳定性,配制的溶液最后要摇匀,因此使用容量瓶之前应检查它是否漏水,A正确;容量瓶用蒸馏水洗净后,不能用待配溶液润洗,否则会导致配制溶液浓度偏高,B错误;定容时,将蒸馏水小心通过玻璃棒引流至容量瓶中,待液面离刻度线1~2cm时,改用胶头滴管滴加至凹液面与刻度线齐平,C错误;配制溶液时,如果试样是液体,用量筒量取试样后应该先在烧杯中进行稀释,待溶液恢复至室温后,再通过玻璃棒引流转移至容量瓶中进行定容,D错误;当溶液的液面至刻度线后,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀,就得到需配制的一定浓度、一定体积的溶液,E正确。综上所述,B、C、D错误。
(3)①在实验室中没有规格是480mL的容量瓶,应该使用500mL的容量瓶,配制500mL0.2mol·L⁻¹的溶液,NaOH的物质的量n(NaOH)=cV=0.2mol·L⁻¹×0.5L=0.1mol,则需称量NaOH的质量m(NaOH)=0.1mol×40g·mol⁻¹=4.0g。②若NaOH溶液在转移至容量瓶时,洒落了少许,则由于溶质损失,导致所得溶液浓度偏低,溶液浓度小于0.2mol·L⁻¹。③NaOH固体溶于水会放出大量的热量,而容量瓶配制溶液的温度是室温,因此若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,当溶液恢复至室温后,液面低于刻度线,溶液体积偏小,由于溶质的物质的量不变,最终导致所得溶液浓度大于0.2mol·L⁻¹。
(3)①4.0 ②< ③>
详解:(1)配制0.2mol·L⁻¹NaOH溶液480mL和0.5mol·L⁻¹硫酸溶液500mL,需要使用500mL的容量瓶配制溶液。用量筒量取水,在烧杯中进行物质的溶解;为促进溶质的溶解,要使用玻璃棒进行搅拌;在转移溶液时要使用玻璃棒引流;最后定容时要使用胶头滴管,不需要使用烧瓶和分液漏斗,故不需使用的仪器序号是AC。配制溶液还需使用的玻璃仪器有烧杯、玻璃棒。
(2)容量瓶是准确配制一定体积、一定物质的量浓度的溶液的仪器。由于溶液具有均一性、稳定性,配制的溶液最后要摇匀,因此使用容量瓶之前应检查它是否漏水,A正确;容量瓶用蒸馏水洗净后,不能用待配溶液润洗,否则会导致配制溶液浓度偏高,B错误;定容时,将蒸馏水小心通过玻璃棒引流至容量瓶中,待液面离刻度线1~2cm时,改用胶头滴管滴加至凹液面与刻度线齐平,C错误;配制溶液时,如果试样是液体,用量筒量取试样后应该先在烧杯中进行稀释,待溶液恢复至室温后,再通过玻璃棒引流转移至容量瓶中进行定容,D错误;当溶液的液面至刻度线后,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀,就得到需配制的一定浓度、一定体积的溶液,E正确。综上所述,B、C、D错误。
(3)①在实验室中没有规格是480mL的容量瓶,应该使用500mL的容量瓶,配制500mL0.2mol·L⁻¹的溶液,NaOH的物质的量n(NaOH)=cV=0.2mol·L⁻¹×0.5L=0.1mol,则需称量NaOH的质量m(NaOH)=0.1mol×40g·mol⁻¹=4.0g。②若NaOH溶液在转移至容量瓶时,洒落了少许,则由于溶质损失,导致所得溶液浓度偏低,溶液浓度小于0.2mol·L⁻¹。③NaOH固体溶于水会放出大量的热量,而容量瓶配制溶液的温度是室温,因此若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,当溶液恢复至室温后,液面低于刻度线,溶液体积偏小,由于溶质的物质的量不变,最终导致所得溶液浓度大于0.2mol·L⁻¹。
查看更多完整答案,请扫码查看


