第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
【例 1】下列关于溶解度的说法正确的是(
A.在温度不变时,溶剂量越多,溶质的溶解度越大
B.$20^{\circ}C$时,$100g$氯化钠饱和溶液中溶解了$26.5g$氯化钠,则$20^{\circ}C$时氯化钠的溶解度为$26.5g$
C.搅拌可以使固体物质的溶解度增大
D.$20^{\circ}C$时,将$31.6g$硝酸钾加入$100g$水中,形成硝酸钾的饱和溶液,则$20^{\circ}C$时,硝酸钾的溶解度为$31.6g$
D
)A.在温度不变时,溶剂量越多,溶质的溶解度越大
B.$20^{\circ}C$时,$100g$氯化钠饱和溶液中溶解了$26.5g$氯化钠,则$20^{\circ}C$时氯化钠的溶解度为$26.5g$
C.搅拌可以使固体物质的溶解度增大
D.$20^{\circ}C$时,将$31.6g$硝酸钾加入$100g$水中,形成硝酸钾的饱和溶液,则$20^{\circ}C$时,硝酸钾的溶解度为$31.6g$
答案:
【例1】 D【解析】在一定温度下,物质溶解的量与溶剂的量成正比,但固体物质的溶解度只受温度影响而不受溶剂多少的影响;搅拌能加快固体溶解的速率,但不能改变固体物质的溶解度。固体物质的溶解度是指某固体物质在一定温度下,在$100g$溶剂里达到饱和状态时所溶解的质量。
【例 2】如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。下列说法正确的是(
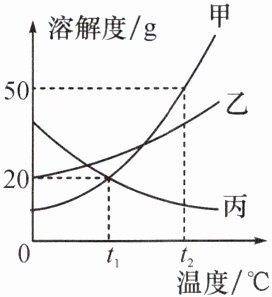
A.甲的溶解度比乙、丙的大
B.甲、丙的两种溶液中溶质质量分数相等
C.$t_{2}^{\circ}C$时,将$50g$甲加入$50g$水中,可得到$100g$溶液
D.将接近饱和的丙溶液转化为饱和溶液,可采用升高温度的方法
D
)
A.甲的溶解度比乙、丙的大
B.甲、丙的两种溶液中溶质质量分数相等
C.$t_{2}^{\circ}C$时,将$50g$甲加入$50g$水中,可得到$100g$溶液
D.将接近饱和的丙溶液转化为饱和溶液,可采用升高温度的方法
答案:
【例2】 D【解析】A. 在比较物质的溶解度时,需要指明温度;B. 没有指明温度,无法判断溶液是否饱和,也无法比较溶质质量分数的大小;C. $t_{2}^{\circ}C$时,甲的溶解度是$50g$,将$50g$甲加入$50g$水中,可得到溶液的质量$=25g + 50g = 75g$;D. 丙的溶解度随温度的升高而减小,可采用升高温度的方法将接近饱和的丙溶液转化为饱和溶液。
【跟踪训练】如图是甲、乙两种物质的溶解度曲线,以下说法正确的是(
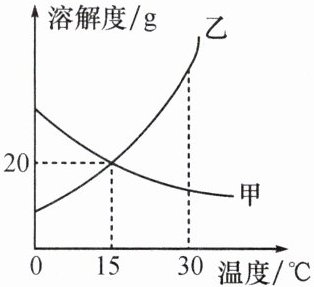
A.$15^{\circ}C$时,甲物质溶液中溶质的质量分数一定等于乙物质溶液中溶质的质量分数
B.$15^{\circ}C$时,甲物质饱和溶液和乙物质饱和溶液中溶质与溶剂的质量比为$1:5$
C.$30^{\circ}C$时,甲物质的饱和溶液和乙物质的饱和溶液降温至$15^{\circ}C$时均是饱和溶液
D.$30^{\circ}C$时,甲物质溶液中溶质的质量分数一定小于乙物质溶液中溶质的质量分数
B
)
A.$15^{\circ}C$时,甲物质溶液中溶质的质量分数一定等于乙物质溶液中溶质的质量分数
B.$15^{\circ}C$时,甲物质饱和溶液和乙物质饱和溶液中溶质与溶剂的质量比为$1:5$
C.$30^{\circ}C$时,甲物质的饱和溶液和乙物质的饱和溶液降温至$15^{\circ}C$时均是饱和溶液
D.$30^{\circ}C$时,甲物质溶液中溶质的质量分数一定小于乙物质溶液中溶质的质量分数
答案:
【跟踪训练】 B
【例 3】在横线上填写分离各混合物所用的主要操作方法。
(1)除去双氧水中的$MnO_{2}$:
(2)从混有少量$KNO_{3}$的$NaCl$溶液中提纯$NaCl$晶体:
(3)从混有少量$NaCl$的$KNO_{3}$溶液中提纯$KNO_{3}$晶体:
(1)除去双氧水中的$MnO_{2}$:
过滤
。(2)从混有少量$KNO_{3}$的$NaCl$溶液中提纯$NaCl$晶体:
蒸发结晶、过滤
。(3)从混有少量$NaCl$的$KNO_{3}$溶液中提纯$KNO_{3}$晶体:
降温结晶、过滤
。
答案:
【例3】
(1)过滤
(2)蒸发结晶、过滤
(3)降温结晶、过滤
【解析】
(1)二氧化锰固体不溶于双氧水,可用固液分离的方法除去;
(2)温度升高时,氯化钠的溶解度变化不大,硝酸钾的溶解度变化很大,所以可采用蒸发结晶、过滤的方法提纯$NaCl$;
(3)根据
(2),可采用冷却热饱和溶液或降温结晶、过滤提纯$KNO_{3}$晶体。
(1)过滤
(2)蒸发结晶、过滤
(3)降温结晶、过滤
【解析】
(1)二氧化锰固体不溶于双氧水,可用固液分离的方法除去;
(2)温度升高时,氯化钠的溶解度变化不大,硝酸钾的溶解度变化很大,所以可采用蒸发结晶、过滤的方法提纯$NaCl$;
(3)根据
(2),可采用冷却热饱和溶液或降温结晶、过滤提纯$KNO_{3}$晶体。
查看更多完整答案,请扫码查看


