第94页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. 下列物质的主要成分不正确的是(
A.磁铁矿(${Fe_{3}O_{4}}$)
B.铝土矿[${Al(OH)_{3}}$]
C.黄铁矿(${FeS_{2}}$)
D.孔雀石(${CuO}$)
D
)A.磁铁矿(${Fe_{3}O_{4}}$)
B.铝土矿[${Al(OH)_{3}}$]
C.黄铁矿(${FeS_{2}}$)
D.孔雀石(${CuO}$)
答案:
1. D
2. (2024·内江改编)如图是实验室模拟工业炼铁的装置。下列有关分析不正确的是(
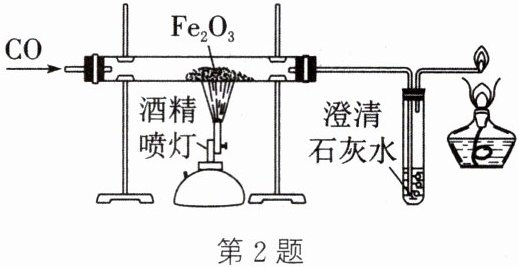
A.澄清石灰水变浑浊,说明有${CO_{2}}$生成
B.该反应中,失去氧的物质是${CO}$
C.${CO}$具有可燃性
D.实验开始时应先通入一氧化碳,目的是排出硬质玻璃管内的空气,防止爆炸
B
)
A.澄清石灰水变浑浊,说明有${CO_{2}}$生成
B.该反应中,失去氧的物质是${CO}$
C.${CO}$具有可燃性
D.实验开始时应先通入一氧化碳,目的是排出硬质玻璃管内的空气,防止爆炸
答案:
2. B
3. “中国高铁,世界第一。”高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理之一是${C + 2NiO\xlongequal{高温}2Ni + CO_{2}\uparrow}$。下列说法正确的是(
A.${NiO}$的名称为镍化氧
B.火法炼镍过程中一定不会产生污染环境的气体
C.该反应一定不是化合反应
D.火法炼镍的反应中${Ni}$元素化合价升高了
C
)A.${NiO}$的名称为镍化氧
B.火法炼镍过程中一定不会产生污染环境的气体
C.该反应一定不是化合反应
D.火法炼镍的反应中${Ni}$元素化合价升高了
答案:
3. C
4. (2023·包头改编)内蒙古矿产资源丰富,某炼铁厂利用焦炭和赤铁矿石作为高炉炼铁的主要原料,其主要反应过程如图所示(部分反应物、生成物及反应条件已略去)。
(1) A 的化学式为
(2) 用化学方程式表示一氧化碳炼铁的原理:
(3) 焦炭的作用是
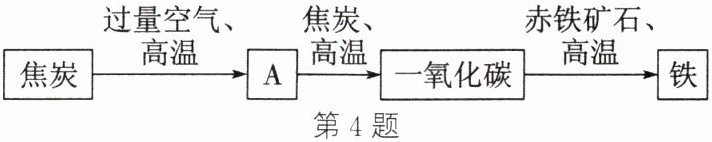
(1) A 的化学式为
CO₂
。(2) 用化学方程式表示一氧化碳炼铁的原理:
$Fe₂O₃+3CO\overset{高温}{\rightarrow}2Fe+3CO₂$
,实际上高炉炼得的铁是生铁,生铁属于混合物
(填“纯净物”或“混合物”)。(3) 焦炭的作用是
燃烧提供热量
、产生还原剂一氧化碳
。炼铁高炉中生铁出口低于炉渣出口的原因为熔化的生铁的密度大于炉渣的密度
。
答案:
$4. (1) CO₂ (2) Fe₂O₃+3CO\overset{高温}{\rightarrow}2Fe+3CO₂ $混合物
(3) 燃烧提供热量 产生还原剂一氧化碳 熔化的生铁的密度大于炉渣的密度
(3) 燃烧提供热量 产生还原剂一氧化碳 熔化的生铁的密度大于炉渣的密度
5. (2024·株洲攸县期末)某钢铁厂每天可冶炼${5 000 t}$含${Fe_{2}O_{3} 76\%}$的赤铁矿石。
(1) 该钢铁厂冶炼赤铁矿的过程,在质量上会遵循
(2) 该厂理论上可日生产含${Fe 98\%}$的生铁的质量是
(1) 该钢铁厂冶炼赤铁矿的过程,在质量上会遵循
质量守恒
定律。(2) 该厂理论上可日生产含${Fe 98\%}$的生铁的质量是
2 714.3 t
(结果精确到${0.1 t}$)。
答案:
$(1)$ 答案
质量守恒
$(2)$ 解答
- 步骤一:计算赤铁矿石中${Fe_{2}O_{3}}$的质量
已知赤铁矿石的质量为$5000t$,其中${Fe_{2}O_{3}}$的质量分数为$76\%$,根据公式$m({Fe_{2}O_{3}})=m(赤铁矿石)× w({Fe_{2}O_{3}})$($m$表示质量,$w$表示质量分数),可得${Fe_{2}O_{3}}$的质量为:
$m({Fe_{2}O_{3}})=5000t×76\% = 3800t$
步骤二:计算${Fe_{2}O_{3}}$中$Fe$元素的质量
根据化合物中某元素质量$=$化合物质量$×$该元素在化合物中的质量分数,${Fe_{2}O_{3}}$中$Fe$元素的质量分数$w(Fe)=\frac{2×56}{2×56 + 3×16}×100\%=\frac{112}{160}×100\% = 70\%$。
则${Fe_{2}O_{3}}$中$Fe$元素的质量$m(Fe)=m({Fe_{2}O_{3}})× w(Fe)=3800t×70\%=2660t$。
步骤三:计算含$Fe\ 98\%$的生铁的质量
设可生产含$Fe\ 98\%$的生铁质量为$x$,根据生铁中$Fe$元素质量等于${Fe_{2}O_{3}}$中$Fe$元素质量,可得$x×98\%=2660t$,即$x = \frac{2660t}{98\%}\approx2714.3t$。
综上,该厂理论上可日生产含$Fe\ 98\%$的生铁的质量是$\boldsymbol{2714.3t}$。
质量守恒
$(2)$ 解答
- 步骤一:计算赤铁矿石中${Fe_{2}O_{3}}$的质量
已知赤铁矿石的质量为$5000t$,其中${Fe_{2}O_{3}}$的质量分数为$76\%$,根据公式$m({Fe_{2}O_{3}})=m(赤铁矿石)× w({Fe_{2}O_{3}})$($m$表示质量,$w$表示质量分数),可得${Fe_{2}O_{3}}$的质量为:
$m({Fe_{2}O_{3}})=5000t×76\% = 3800t$
步骤二:计算${Fe_{2}O_{3}}$中$Fe$元素的质量
根据化合物中某元素质量$=$化合物质量$×$该元素在化合物中的质量分数,${Fe_{2}O_{3}}$中$Fe$元素的质量分数$w(Fe)=\frac{2×56}{2×56 + 3×16}×100\%=\frac{112}{160}×100\% = 70\%$。
则${Fe_{2}O_{3}}$中$Fe$元素的质量$m(Fe)=m({Fe_{2}O_{3}})× w(Fe)=3800t×70\%=2660t$。
步骤三:计算含$Fe\ 98\%$的生铁的质量
设可生产含$Fe\ 98\%$的生铁质量为$x$,根据生铁中$Fe$元素质量等于${Fe_{2}O_{3}}$中$Fe$元素质量,可得$x×98\%=2660t$,即$x = \frac{2660t}{98\%}\approx2714.3t$。
综上,该厂理论上可日生产含$Fe\ 98\%$的生铁的质量是$\boldsymbol{2714.3t}$。
6. 利用如图所示的实验装置模拟工业炼铁。下列说法正确的是(
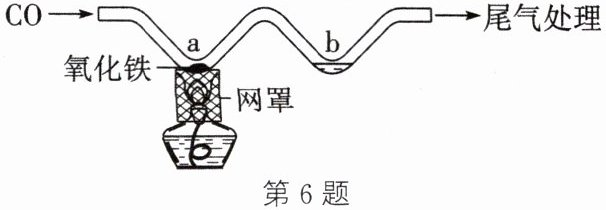
A.反应前后${Fe}$元素的化合价由$+2$变为$0$
B.氧化铁的质量可能减少
C.${b}$处可以用澄清石灰水检验气体产物
D.可用水吸收尾气中的${CO}$
C
)
A.反应前后${Fe}$元素的化合价由$+2$变为$0$
B.氧化铁的质量可能减少
C.${b}$处可以用澄清石灰水检验气体产物
D.可用水吸收尾气中的${CO}$
答案:
6. C
查看更多完整答案,请扫码查看


