第73页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
(1)反应生成$CO_{2}$的质量为
(2)石灰石样品中碳酸钙的质量。
解:设石灰石样品中碳酸钙的质量为x。
$CaCO_{3} + 2HCl\xlongequal {}CaCl_{2} + H_{2}O + CO_{2}\uparrow$
100 44
x 4.4g
列出比例式:①
求解$x = $②
答:石灰石样品中碳酸钙的质量是(略)。
4.4
g;(2)石灰石样品中碳酸钙的质量。
解:设石灰石样品中碳酸钙的质量为x。
$CaCO_{3} + 2HCl\xlongequal {}CaCl_{2} + H_{2}O + CO_{2}\uparrow$
100 44
x 4.4g
列出比例式:①
$\frac{100}{44}=\frac{x}{4.4\ \text{g}}$
求解$x = $②
10 g
答:石灰石样品中碳酸钙的质量是(略)。
答案:
5.
(1)4.4
(2)①$\frac{100}{44}$=$\frac{x}{4.4\ \text{g}}$ ②10 g
【解析】
(1)根据质量守恒定律,化学反应前后物质的总质量不变,则反应生成CO₂的质量为310.4 g-306 g=4.4 g。
(2)解:设石灰石样品中碳酸钙的质量为x。
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4\ \text{g}}$
x=10 g
答:石灰石样品中碳酸钙的质量是10 g。
(1)4.4
(2)①$\frac{100}{44}$=$\frac{x}{4.4\ \text{g}}$ ②10 g
【解析】
(1)根据质量守恒定律,化学反应前后物质的总质量不变,则反应生成CO₂的质量为310.4 g-306 g=4.4 g。
(2)解:设石灰石样品中碳酸钙的质量为x。
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4\ \text{g}}$
x=10 g
答:石灰石样品中碳酸钙的质量是10 g。
6[2025湖南衡阳质检]实验室加热高锰酸钾来制取氧气,生成气体的体积与加热时间关系如图所示(标准状况下,氧气的密度为1.429g/L,计算结果均保留整数)。
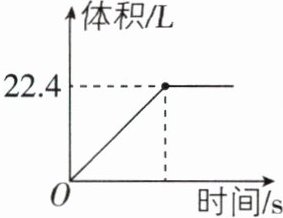
计算:
(1)生成的氧气的体积是
(2)该过程中有多少克高锰酸钾参加反应?(写出计算过程)
解:生成氧气的质量为22.4 L×1.429 g/L≈32 g,设参加反应的高锰酸钾的质量为x。
2KMnO₄$\stackrel{\triangle}{=}$K₂MnO₄+MnO₂+O₂↑
316 32
x 32 g
$\frac{316}{32}$=$\frac{x}{32\ \text{g}}$
x=$\frac{316×32\ \text{g}}{32}$=316 g
答:该过程中有316 g高锰酸钾参加反应。

计算:
(1)生成的氧气的体积是
22.4
L。(2)该过程中有多少克高锰酸钾参加反应?(写出计算过程)
解:生成氧气的质量为22.4 L×1.429 g/L≈32 g,设参加反应的高锰酸钾的质量为x。
2KMnO₄$\stackrel{\triangle}{=}$K₂MnO₄+MnO₂+O₂↑
316 32
x 32 g
$\frac{316}{32}$=$\frac{x}{32\ \text{g}}$
x=$\frac{316×32\ \text{g}}{32}$=316 g
答:该过程中有316 g高锰酸钾参加反应。
答案:
6.
(1)22.4
(2)解:生成氧气的质量为22.4 L×1.429 g/L≈32 g,设参加反应的高锰酸钾的质量为x。
2KMnO₄$\stackrel{\triangle}{=}$K₂MnO₄+MnO₂+O₂↑
316 32
x 32 g
$\frac{316}{32}$=$\frac{x}{32\ \text{g}}$
x=$\frac{316×32\ \text{g}}{32}$=316 g
答:该过程中有316 g高锰酸钾参加反应。
【解析】
(1)由题图可知,生成氧气的体积是22.4 L。
(2)生成氧气的质量为22.4 L×1.429 g/L≈32 g,根据化学方程式进行计算。
(1)22.4
(2)解:生成氧气的质量为22.4 L×1.429 g/L≈32 g,设参加反应的高锰酸钾的质量为x。
2KMnO₄$\stackrel{\triangle}{=}$K₂MnO₄+MnO₂+O₂↑
316 32
x 32 g
$\frac{316}{32}$=$\frac{x}{32\ \text{g}}$
x=$\frac{316×32\ \text{g}}{32}$=316 g
答:该过程中有316 g高锰酸钾参加反应。
【解析】
(1)由题图可知,生成氧气的体积是22.4 L。
(2)生成氧气的质量为22.4 L×1.429 g/L≈32 g,根据化学方程式进行计算。
7[2025江西宜春质检]同学们采集到一种石灰石(主要成分是$CaCO_{3}$),他们取80g该样品进行高温煅烧(所含杂质在煅烧过程不发生变化),得到生石灰$(CaO)$和二氧化碳,测得反应后固体的质量与反应时间的关系如表所示。
|反应时间/s|$t_{0}$|$t_{1}$|$t_{2}$|$t_{3}$|$t_{4}$|$t_{5}$|$t_{6}$|
|反应后固体的质量/g|80|75|70|66|62|58|58|
请回答下列问题。
(1)当石灰石完全反应后,生成二氧化碳的质量为
(2)求该样品中碳酸钙的质量分数,写出计算过程。
(3)$t_{0}\sim t_{6}s$固体中钙元素的质量分数
|反应时间/s|$t_{0}$|$t_{1}$|$t_{2}$|$t_{3}$|$t_{4}$|$t_{5}$|$t_{6}$|
|反应后固体的质量/g|80|75|70|66|62|58|58|
请回答下列问题。
(1)当石灰石完全反应后,生成二氧化碳的质量为
22
g。(2)求该样品中碳酸钙的质量分数,写出计算过程。
解:设样品中含CaCO₃的质量为x。
CaCO₃$\stackrel{\text{高温}}{=}$CaO+CO₂↑
100 44
x 22 g
$\frac{100}{44}$=$\frac{x}{22\ \text{g}}$
x=$\frac{100×22\ \text{g}}{44}$=50 g
样品中CaCO₃的质量分数=$\frac{50\ \text{g}}{80\ \text{g}}$×100%=62.5%。
答:该样品中CaCO₃的质量分数为62.5%。
CaCO₃$\stackrel{\text{高温}}{=}$CaO+CO₂↑
100 44
x 22 g
$\frac{100}{44}$=$\frac{x}{22\ \text{g}}$
x=$\frac{100×22\ \text{g}}{44}$=50 g
样品中CaCO₃的质量分数=$\frac{50\ \text{g}}{80\ \text{g}}$×100%=62.5%。
答:该样品中CaCO₃的质量分数为62.5%。
(3)$t_{0}\sim t_{6}s$固体中钙元素的质量分数
先增大后不变
(填“逐渐增大”“逐渐减小”“先增大后不变”“先减小后不变”或“一直不变”)。
答案:
7.
(1)22
(2)解:设样品中含CaCO₃的质量为x。
CaCO₃$\stackrel{\text{高温}}{=}$CaO+CO₂↑
100 44
x 22 g
$\frac{100}{44}$=$\frac{x}{22\ \text{g}}$
x=$\frac{100×22\ \text{g}}{44}$=50 g
样品中CaCO₃的质量分数=$\frac{50\ \text{g}}{80\ \text{g}}$×100%=62.5%。
答:该样品中CaCO₃的质量分数为62.5%。
(3)先增大后不变
【解析】
(1)固体的质量由80 g最终变为58 g,减少了22 g,说明生成的气体的质量为22 g。
(3)碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,t₀~t₅ s过程中固体的质量不断减小,当碳酸钙完全分解后,即t₅ s后固体的质量不再改变,所以t₀~t₆ s固体中钙元素的质量分数先增大后不变。
(1)22
(2)解:设样品中含CaCO₃的质量为x。
CaCO₃$\stackrel{\text{高温}}{=}$CaO+CO₂↑
100 44
x 22 g
$\frac{100}{44}$=$\frac{x}{22\ \text{g}}$
x=$\frac{100×22\ \text{g}}{44}$=50 g
样品中CaCO₃的质量分数=$\frac{50\ \text{g}}{80\ \text{g}}$×100%=62.5%。
答:该样品中CaCO₃的质量分数为62.5%。
(3)先增大后不变
【解析】
(1)固体的质量由80 g最终变为58 g,减少了22 g,说明生成的气体的质量为22 g。
(3)碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,t₀~t₅ s过程中固体的质量不断减小,当碳酸钙完全分解后,即t₅ s后固体的质量不再改变,所以t₀~t₆ s固体中钙元素的质量分数先增大后不变。
查看更多完整答案,请扫码查看


