2026年天利38套学业水平考试高中化学全一册人教版江苏专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年天利38套学业水平考试高中化学全一册人教版江苏专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
30.(10 分)焦亚硫酸钠(Na₂S₂O₅)是常用的抗氧化剂,在空气中、受热时均易分解。
(1)化学兴趣小组同学利用如图所示装置(部分夹持装置已略去,实验前已除去装置中的空气)制取 Na₂S₂O₅。
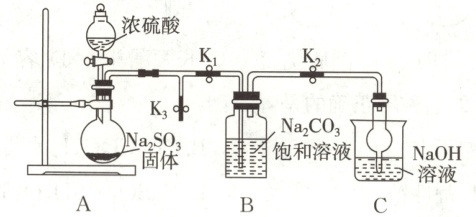
打开 K₁ 和 K₂,关闭 K₃,制取 Na₂S₂O₅。
①Na₂S₂O₅ 中 O 元素化合价为 -2,其中 S 元素的化合价为
②B 中通入过量 SO₂ 充分反应后,经冷却结晶时发生反应:2NaHSO₃ = Na₂S₂O₅ + H₂O,可获得 Na₂S₂O₅ 晶体。B 中生成 NaHSO₃ 的化学方程式为
③B 中所得 Na₂S₂O₅ 晶体常用饱和 SO₂ 水溶液洗涤。用饱和 SO₂ 水溶液洗涤的目的除洗去产物表面的杂质离子外还有
(2)葡萄酒中常加入 Na₂S₂O₅ 作抗氧化剂。测定某葡萄酒中 Na₂S₂O₅ 残留量的实验步骤如下:取 50.00 mL 葡萄酒样品,加入 0.0100 mol/L 的 I₂ 标准液至恰好完全反应,消耗碘标准液 10.00 mL,已知发生的反应为 S₂O₅²⁻ + I₂ + H₂O → SO₄²⁻ + I⁻ + H⁺(未配平)。计算该葡萄酒中 Na₂S₂O₅ 的残留量(以 g/L 为单位,写出计算过程)。
(1)化学兴趣小组同学利用如图所示装置(部分夹持装置已略去,实验前已除去装置中的空气)制取 Na₂S₂O₅。

打开 K₁ 和 K₂,关闭 K₃,制取 Na₂S₂O₅。
①Na₂S₂O₅ 中 O 元素化合价为 -2,其中 S 元素的化合价为
+4
;装置 C 中干燥管的作用是防止倒吸
。②B 中通入过量 SO₂ 充分反应后,经冷却结晶时发生反应:2NaHSO₃ = Na₂S₂O₅ + H₂O,可获得 Na₂S₂O₅ 晶体。B 中生成 NaHSO₃ 的化学方程式为
H₂O + Na₂CO₃ + 2SO₂ = CO₂ + 2NaHSO₃
。③B 中所得 Na₂S₂O₅ 晶体常用饱和 SO₂ 水溶液洗涤。用饱和 SO₂ 水溶液洗涤的目的除洗去产物表面的杂质离子外还有
减少Na₂S₂O₅在水中的溶解量
。(2)葡萄酒中常加入 Na₂S₂O₅ 作抗氧化剂。测定某葡萄酒中 Na₂S₂O₅ 残留量的实验步骤如下:取 50.00 mL 葡萄酒样品,加入 0.0100 mol/L 的 I₂ 标准液至恰好完全反应,消耗碘标准液 10.00 mL,已知发生的反应为 S₂O₅²⁻ + I₂ + H₂O → SO₄²⁻ + I⁻ + H⁺(未配平)。计算该葡萄酒中 Na₂S₂O₅ 的残留量(以 g/L 为单位,写出计算过程)。
答案:
30.(10分)
(1)① + 4 (1分) 防止倒吸 (1分) ②H₂O + Na₂CO₃ + 2SO₂$\xlongequal{}$CO₂ + 2NaHSO₃ (2分) ③减少Na₂S₂O₅在水中的溶解量 (2分)
(2)S₂O₅²⁻ + 2I₂ + 3H₂O$\xlongequal{}$2SO₄²⁻ + 4I⁻ + 6H⁺(或S₂O₅²⁻ ~ 2I₂) (2分) 50.00mL葡萄酒样品中n(Na₂S₂O₅) = $\frac{1}{2}$×0.0100mol/L×10.00mL×10⁻³L/mL = 5×10⁻⁵mol (1分)
Na₂S₂O₅的残留量 = $\frac{5×10^{-5} mol×190 g/mol}{50.00 mL×10^{-3} L/mL}$ = 0.190g/L (1分)
【解析】常见无机物的制备
(1)①Na₂S₂O₅中O元素化合价为−2,Na元素为 + 1价,故其中S元素的化合价为 + 4;装置C中用氢氧化钠溶液吸收尾气二氧化硫,二氧化硫易溶于水,故装置C中干燥管的作用为防倒吸。②B中饱和碳酸钠溶液和二氧化硫气体反应生成亚硫酸氢钠,化学方程式为2SO₂ + Na₂CO₃ + H₂O$\xlongequal{}$2NaHSO₃ + CO₂。③用饱和SO₂水溶液洗涤Na₂S₂O₅晶体,可洗去产物表面的杂质离子,且能减少Na₂S₂O₅在水中的溶解量。
(2)配平发生反应的离子方程式为S₂O₅²⁻ + 2I₂ + 3H₂O$\xlongequal{}$2SO₄²⁻ + 4I⁻ + 6H⁺,根据比例关系计算。
(1)① + 4 (1分) 防止倒吸 (1分) ②H₂O + Na₂CO₃ + 2SO₂$\xlongequal{}$CO₂ + 2NaHSO₃ (2分) ③减少Na₂S₂O₅在水中的溶解量 (2分)
(2)S₂O₅²⁻ + 2I₂ + 3H₂O$\xlongequal{}$2SO₄²⁻ + 4I⁻ + 6H⁺(或S₂O₅²⁻ ~ 2I₂) (2分) 50.00mL葡萄酒样品中n(Na₂S₂O₅) = $\frac{1}{2}$×0.0100mol/L×10.00mL×10⁻³L/mL = 5×10⁻⁵mol (1分)
Na₂S₂O₅的残留量 = $\frac{5×10^{-5} mol×190 g/mol}{50.00 mL×10^{-3} L/mL}$ = 0.190g/L (1分)
【解析】常见无机物的制备
(1)①Na₂S₂O₅中O元素化合价为−2,Na元素为 + 1价,故其中S元素的化合价为 + 4;装置C中用氢氧化钠溶液吸收尾气二氧化硫,二氧化硫易溶于水,故装置C中干燥管的作用为防倒吸。②B中饱和碳酸钠溶液和二氧化硫气体反应生成亚硫酸氢钠,化学方程式为2SO₂ + Na₂CO₃ + H₂O$\xlongequal{}$2NaHSO₃ + CO₂。③用饱和SO₂水溶液洗涤Na₂S₂O₅晶体,可洗去产物表面的杂质离子,且能减少Na₂S₂O₅在水中的溶解量。
(2)配平发生反应的离子方程式为S₂O₅²⁻ + 2I₂ + 3H₂O$\xlongequal{}$2SO₄²⁻ + 4I⁻ + 6H⁺,根据比例关系计算。
查看更多完整答案,请扫码查看


