2026年天利38套学业水平考试高中化学全一册人教版江苏专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年天利38套学业水平考试高中化学全一册人教版江苏专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
20.下列关于过氧化钠的性质和用途的描述正确的是
(
A.过氧化钠是一种淡黄色固体,性质非常活泼
B.过氧化钠需要密封保存是因为它能与空气中的所有成分反应
C.过氧化钠与二氧化碳的反应很慢,且该反应吸热
D.过氧化钠属于碱性氧化物,能与酸反应生成盐和水
(
A
)A.过氧化钠是一种淡黄色固体,性质非常活泼
B.过氧化钠需要密封保存是因为它能与空气中的所有成分反应
C.过氧化钠与二氧化碳的反应很慢,且该反应吸热
D.过氧化钠属于碱性氧化物,能与酸反应生成盐和水
答案:
20.A[解析]过氧化钠的性质与用途 Na₂O₂是一种淡黄色固体,具有氧化性和还原性,性质非常活泼,A项正确;Na₂O₂需要密封保存是因为它能与空气中的H₂O和CO₂反应,Na₂O₂不与N₂和O₂等反应,B项错误;Na₂O₂与CO₂的反应很快,且该反应放热,C项错误;Na₂O₂不属于碱性氧化物,能与酸反应生成盐、水和O₂,D项错误。
21.在元素周期表中,元素性质随原子序数的递增呈现周期性变化的
本质原因是
(
A.中子数逐渐增大
B.相对原子质量逐渐增大
C.核外电子排布呈现周期性变化
D.元素化合价呈现周期性变化
本质原因是
(
C
)A.中子数逐渐增大
B.相对原子质量逐渐增大
C.核外电子排布呈现周期性变化
D.元素化合价呈现周期性变化
答案:
21.C[解析]元素周期表 在元素周期表中,元素性质随原子序数的递增呈现周期性变化的本质原因是核外电子排布呈现周期性变化,C符合题意。
22.下列物质转化符合工业生产实际的是
(
A.$Cl_2\xrightarrow[澄清石灰水]{}漂白粉$
B.饱和食盐水$\xrightarrow[②足量CO_2]{①足量NH_3}NaHCO_3$固体
C.$TiCl_4$溶液$\xrightarrow{Na}Ti$
D.$S\xrightarrow[点燃]{过量O_2}SO_3$
(
B
)A.$Cl_2\xrightarrow[澄清石灰水]{}漂白粉$
B.饱和食盐水$\xrightarrow[②足量CO_2]{①足量NH_3}NaHCO_3$固体
C.$TiCl_4$溶液$\xrightarrow{Na}Ti$
D.$S\xrightarrow[点燃]{过量O_2}SO_3$
答案:
22.B[解析]物质的转化 工业上制漂白粉时,将Cl₂通入石灰乳中(易错点),A错误;侯氏制碱法是向饱和食盐水中先通入足量NH₃,再通入足量CO₂,制得NaHCO₃,NaHCO₃受热分解生成Na₂CO₃,B正确;Na和熔融TiCl₄发生置换反应生成Ti(易错点),C错误;S和O₂在点燃条件下生成SO₂,而非SO₃,D错误。
知识拓展:侯氏制碱法:①向饱和食盐水中先通入NH₃,后通入CO₂,先通入NH₃使食盐水显碱性,能够吸收大量CO₂气体,产生高浓度的HCO₃⁻,才能析出NaHCO₃晶体,化学方程式为NaCl + NH₃ + H₂O + CO₂ = NH₄Cl + NaHCO₃↓;②NaHCO₃受热分解,化学方程式为2NaHCO₃ △ Na₂CO₃ + H₂O + CO₂↑。
知识拓展:侯氏制碱法:①向饱和食盐水中先通入NH₃,后通入CO₂,先通入NH₃使食盐水显碱性,能够吸收大量CO₂气体,产生高浓度的HCO₃⁻,才能析出NaHCO₃晶体,化学方程式为NaCl + NH₃ + H₂O + CO₂ = NH₄Cl + NaHCO₃↓;②NaHCO₃受热分解,化学方程式为2NaHCO₃ △ Na₂CO₃ + H₂O + CO₂↑。
23.甲~戊均为短周期元素,在元素周期表中的相对位置如图所示;戊
的最高价氧化物对应的水化物为强酸。下列说法不正确的是
(

A.原子半径:丁>戊>乙
B.非金属性:戊>丁>丙
C.甲的氢化物遇氯化氢一定有白烟产生
D.丙的最高价氧化物对应的水化物一定能与强碱反应
的最高价氧化物对应的水化物为强酸。下列说法不正确的是
(
C
)
A.原子半径:丁>戊>乙
B.非金属性:戊>丁>丙
C.甲的氢化物遇氯化氢一定有白烟产生
D.丙的最高价氧化物对应的水化物一定能与强碱反应
答案:
23.C[解析]元素周期表与元素周期律 根据题意,甲、乙、丙、丁、戊均为短周期元素,戊的最高价氧化物对应的水化物为强酸,故戊可能是Cl元素,也可能是S元素,若戊为Cl元素,则甲、乙、丙、丁分别为N、F、P、S,若戊为S元素,则甲、乙、丙、丁分别为C、O、Si、P,据此解答。甲的简单氢化物可能是氨气或甲烷,甲烷遇氯化氢不产生白烟,C错误;故选C。
24.设$N_A$为阿伏加德罗常数的值,下列说法正确的是
(
A.标准状况下,每生成2.24L$O_2$,转移的电子数一定为0.4$N_A$
B.常温下,32g$O_2$和$O_3$的混合气体含有的分子总数小于$N_A$
C.常温常压下,1.8g$D_2O$中含有的中子数为$N_A$
D.20℃500mL2mol/L$H_2SO_4$溶液里所含有的氧原子数是2$N_A$
(
B
)A.标准状况下,每生成2.24L$O_2$,转移的电子数一定为0.4$N_A$
B.常温下,32g$O_2$和$O_3$的混合气体含有的分子总数小于$N_A$
C.常温常压下,1.8g$D_2O$中含有的中子数为$N_A$
D.20℃500mL2mol/L$H_2SO_4$溶液里所含有的氧原子数是2$N_A$
答案:
24.B[解析]阿伏加德罗常数的相关计算 化合物中氧元素的化合价有 -1、-2,每生成0.1 mol O₂,转移的电子数不一定是0.4Nₐ,A错误;32 g O₂含有的分子总数等于Nₐ,32 g O₃含有的分子总数小于Nₐ,所以32 g O₂和O₃的混合气体含有的分子总数小于Nₐ,B正确;D₂O的相对分子质量是20,1.8 g D₂O的物质的量小于0.1 mol,中子数小于Nₐ,C错误;溶液由溶质和溶剂两部分组成,500 mL 2 mol/L H₂SO₄溶液中溶质所含有的氧原子数是4Nₐ,溶剂水中还含有氧原子,D错误。
25.为除去括号内的杂质,所选用的试剂或方法正确的是
(
A.$CO_2$气体(HCl):饱和$Na_2CO_3$溶液
B.$Na_2CO_3$溶液($NaHCO_3$):加入过量的NaOH溶液
C.$Na_2O_2$粉末($Na_2O$):将混合物在氧气中加热
D.$Na_2CO_3$溶液($Na_2SO_4$):加入适量$Ba(OH)_2$溶液,过滤
(
C
)A.$CO_2$气体(HCl):饱和$Na_2CO_3$溶液
B.$Na_2CO_3$溶液($NaHCO_3$):加入过量的NaOH溶液
C.$Na_2O_2$粉末($Na_2O$):将混合物在氧气中加热
D.$Na_2CO_3$溶液($Na_2SO_4$):加入适量$Ba(OH)_2$溶液,过滤
答案:
25.C[解析]物质的除杂 除去二氧化碳中混有的氯化氢,应选用饱和的碳酸氢钠溶液,二氧化碳能和饱和碳酸钠溶液发生反应,不符合除杂原则,A错误;氢氧化钠能和碳酸氢钠反应生成碳酸钠和水,但由于加入的氢氧化钠溶液过量,引入了新的杂质,不符合除杂原则,B错误;将混合物在氧气中加热时,过氧化钠不发生反应,氧化钠和氧气反应生成过氧化钠,C正确;氢氧化钡和硫酸钠溶液反应生成硫酸钡沉淀和氢氧化钠,氢氧化钡和碳酸钠溶液反应生成碳酸钡沉淀和氢氧化钠,除去了要保留的物质的同时还引入了新的杂质,不能达到除杂的目的,D错误。
26.如图,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔
板,在A、B、C内分别充入等质量的X、$CO_2$、Y三种气体,当隔板
静止时,A、C内的气体密度相等。下列说法不正确的是
(
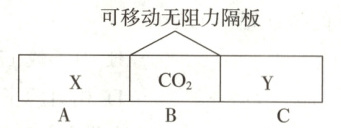
A.物质的量:$n(X)<n(CO_2)<n(Y)$
B.分子数目:$N(X)=N(Y)$
C.气体的体积:$V(X)=V(Y)$
D.摩尔质量:$M(X)=M(Y)$
板,在A、B、C内分别充入等质量的X、$CO_2$、Y三种气体,当隔板
静止时,A、C内的气体密度相等。下列说法不正确的是
(
A
)
A.物质的量:$n(X)<n(CO_2)<n(Y)$
B.分子数目:$N(X)=N(Y)$
C.气体的体积:$V(X)=V(Y)$
D.摩尔质量:$M(X)=M(Y)$
答案:
26.A[解析]阿伏加德罗定律及其推论 当隔板静止时,隔板两侧气体的压强相等,容器恒温,所以处于同温同压的环境。同温同压下,气体的密度之比等于其摩尔质量之比。A、C内的气体密度相等,所以气体X、Y的摩尔质量相等。充入的三种气体的质量相等,所以X、Y物质的量一定相等,A错误;X、Y物质的量相等,即分子数目相等,B正确;X、Y物质的量相等,同温同压下气体的体积一定相等,C正确;根据上述分析可知,气体X、Y的摩尔质量相等,D正确。
查看更多完整答案,请扫码查看


