第191页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
5. 某班同学取用相同总质量的木炭粉和氧化铜的混合物,按图示装置进行实验。实验过程中发现有的小组“黑色固体变红色”这一实验现象不明显。小组同学对此异常现象进行了如下探究。
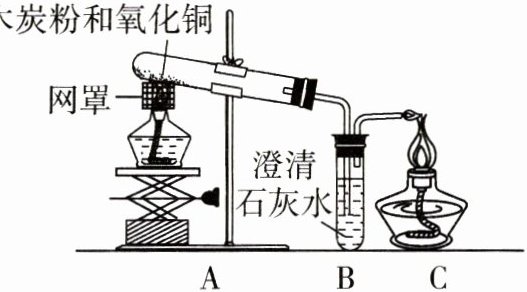
【知识回忆】碳和氧化铜反应的化学方程式为 $C + 2CuO \overset{高温}{=} 2Cu + CO_{2} \uparrow$,理论上碳和氧化铜的质量比为
【作出猜想】产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
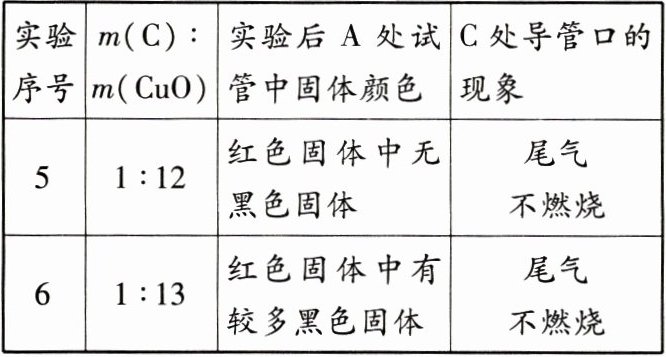
【实验探究】小组同学用总质量相同但质量比不同的木炭粉和氧化铜的混合物(不考虑其中杂质),分别进行实验,部分实验现象记录如下:

【交流讨论】
(1) 推测实验 4 中“C 处导管口的现象”是
(2) 上述探究可得出,实验时所用木炭粉和氧化铜的质量比为 1 : 10 ~ 1 : 12 时,可观察到黑色固体明显变红,同时还可减少
【反思评价】分析发现,实验 5 中 $m(C) : m(CuO)$ 的值与理论值不符,实验后却无黑色固体残留。请用化学方程式解释实验中过量的黑色固体消失的原因:

【知识回忆】碳和氧化铜反应的化学方程式为 $C + 2CuO \overset{高温}{=} 2Cu + CO_{2} \uparrow$,理论上碳和氧化铜的质量比为
12:160(或 3:40)
。【作出猜想】产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
【实验探究】小组同学用总质量相同但质量比不同的木炭粉和氧化铜的混合物(不考虑其中杂质),分别进行实验,部分实验现象记录如下:


【交流讨论】
(1) 推测实验 4 中“C 处导管口的现象”是
尾气不燃烧
。(2) 上述探究可得出,实验时所用木炭粉和氧化铜的质量比为 1 : 10 ~ 1 : 12 时,可观察到黑色固体明显变红,同时还可减少
CO
(填化学式)的排放,防止空气污染。【反思评价】分析发现,实验 5 中 $m(C) : m(CuO)$ 的值与理论值不符,实验后却无黑色固体残留。请用化学方程式解释实验中过量的黑色固体消失的原因:
$2\mathrm{C}+{\mathrm{O}}_{2}\xlongequal{点燃}2\mathrm{C}\mathrm{O}$(或$\mathrm{C}+{\mathrm{O}}_{2}\xlongequal{点燃}\mathrm{C}{\mathrm{O}}_{2}$,$\mathrm{C}+\mathrm{C}{\mathrm{O}}_{2}\xlongequal{高温}2\mathrm{C}\mathrm{O}$,写一个即可)
(写出一个即可)。
答案:
【知识回忆】12:160(或 3:40)
【交流讨论】
(1)尾气不燃烧
(2)CO
【反思评价】$2\mathrm{C}+{\mathrm{O}}_{2}\xlongequal{点燃}2\mathrm{C}\mathrm{O}$(或$\mathrm{C}+{\mathrm{O}}_{2}\xlongequal{点燃}\mathrm{C}{\mathrm{O}}_{2}$,$\mathrm{C}+\mathrm{C}{\mathrm{O}}_{2}\xlongequal{高温}2\mathrm{C}\mathrm{O}$,写一个即可)
【解析】【知识回忆】根据化学方程式可知,理论上碳和氧化铜的质量比为$12\colon (2× 80)=12\colon 160=3\colon 40$。【交流讨论】
(1)实验 3、实验 5“C 处导管口的现象”均为“尾气不燃烧”,可知实验 4 中的“C 处导管口的现象”也应为“尾气不燃烧”。
(2)根据反应前后元素种类不变,且反应物为 C 和 CuO,可知尾气燃烧是因为尾气中含 CO。控制反应物比例,可减少 CO 排放,防止空气污染。【反思评价】实验 5 中所用$m(\mathrm{C})\colon m(\mathrm{C}\mathrm{u}\mathrm{O})$的值比理论值大,说明碳除了与 CuO 反应外,还参与了其他反应,故过量黑色固体消失的原因可能是碳与空气中的 O₂ 或生成物 CO₂ 发生了反应。
【交流讨论】
(1)尾气不燃烧
(2)CO
【反思评价】$2\mathrm{C}+{\mathrm{O}}_{2}\xlongequal{点燃}2\mathrm{C}\mathrm{O}$(或$\mathrm{C}+{\mathrm{O}}_{2}\xlongequal{点燃}\mathrm{C}{\mathrm{O}}_{2}$,$\mathrm{C}+\mathrm{C}{\mathrm{O}}_{2}\xlongequal{高温}2\mathrm{C}\mathrm{O}$,写一个即可)
【解析】【知识回忆】根据化学方程式可知,理论上碳和氧化铜的质量比为$12\colon (2× 80)=12\colon 160=3\colon 40$。【交流讨论】
(1)实验 3、实验 5“C 处导管口的现象”均为“尾气不燃烧”,可知实验 4 中的“C 处导管口的现象”也应为“尾气不燃烧”。
(2)根据反应前后元素种类不变,且反应物为 C 和 CuO,可知尾气燃烧是因为尾气中含 CO。控制反应物比例,可减少 CO 排放,防止空气污染。【反思评价】实验 5 中所用$m(\mathrm{C})\colon m(\mathrm{C}\mathrm{u}\mathrm{O})$的值比理论值大,说明碳除了与 CuO 反应外,还参与了其他反应,故过量黑色固体消失的原因可能是碳与空气中的 O₂ 或生成物 CO₂ 发生了反应。
6. 竹炭包是一种集观赏与空气净化为一体的产品。这种产品可对车内及室内空气中的一氧化碳、甲醛等有害气体进行吸附。某课外活动小组对竹炭进行初步探究。
【提出问题】竹炭中是否含有碳元素。
【猜想与假设】竹炭中含有碳元素。
【查阅资料】新鲜的血液遇一氧化碳由鲜红色变为暗红色。
【设计实验】所用装置如图所示。A 装置的作用为吸收空气中的水和二氧化碳;如有二氧化碳产生,D 装置用于除尽产生的二氧化碳气体。

(1) 实验开始后,C 装置中产生白色沉淀,其中发生反应的化学方程式为
(2) 小玥认为应在 A、B 装置间再增加一个 C 装置,目的是
(3) 课外活动小组的同学设计的这套装置的不足之处是
(4) 小亮认为可以用如图所示的装置替换原装置中的 E 装置,你认为

【结论】竹炭中含有碳元素。
【拓展应用】竹炭细密多孔,竹炭牙膏中因含有竹炭等成分而具有消炎、止痛、化瘀、去污等功效,下列有关竹炭牙膏的用途的描述不正确的是
A. 可除去衣领、袖口等处的汗渍
B. 不能除去口中异味
C. 可用于虫咬、灼伤的消炎止痛
【提出问题】竹炭中是否含有碳元素。
【猜想与假设】竹炭中含有碳元素。
【查阅资料】新鲜的血液遇一氧化碳由鲜红色变为暗红色。
【设计实验】所用装置如图所示。A 装置的作用为吸收空气中的水和二氧化碳;如有二氧化碳产生,D 装置用于除尽产生的二氧化碳气体。

(1) 实验开始后,C 装置中产生白色沉淀,其中发生反应的化学方程式为
$\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H}{)}_{2}+\mathrm{C}{\mathrm{O}}_{2}\xlongequal{}\mathrm{C}\mathrm{a}\mathrm{C}{\mathrm{O}}_{3}\downarrow +{\mathrm{H}}_{2}\mathrm{O}$
,E 装置中新鲜的鸡血变为暗红色。(2) 小玥认为应在 A、B 装置间再增加一个 C 装置,目的是
检验二氧化碳是否已被除尽
。(3) 课外活动小组的同学设计的这套装置的不足之处是
没有进行尾气处理
,解决方法是 在 a 处加一盏点燃的酒精灯或套上一个气球
。(4) 小亮认为可以用如图所示的装置替换原装置中的 E 装置,你认为
不可以
(填“可以”或“不可以”),原因是 E 装置中通入的气体可能是一氧化碳和氧气的混合气体,加热时可能发生爆炸
。
【结论】竹炭中含有碳元素。
【拓展应用】竹炭细密多孔,竹炭牙膏中因含有竹炭等成分而具有消炎、止痛、化瘀、去污等功效,下列有关竹炭牙膏的用途的描述不正确的是
B
(填字母)。A. 可除去衣领、袖口等处的汗渍
B. 不能除去口中异味
C. 可用于虫咬、灼伤的消炎止痛
答案:
【设计实验】
(1)$\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H}{)}_{2}+\mathrm{C}{\mathrm{O}}_{2}\xlongequal{}\mathrm{C}\mathrm{a}\mathrm{C}{\mathrm{O}}_{3}\downarrow +{\mathrm{H}}_{2}\mathrm{O}$
(2)检验二氧化碳是否已被除尽
(3)没有进行尾气处理 在 a 处加一盏点燃的酒精灯或套上一个气球
(4)不可以 E 装置中通入的气体可能是一氧化碳和氧气的混合气体,加热时可能发生爆炸
【拓展应用】B
【解析】【设计实验】
(1)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水。
(2)A 装置的主要作用是除去空气中的二氧化碳,防止其影响后续检验,故在 A、B 装置间增加装有澄清石灰水的装置,目的是检验二氧化碳是否已被除尽。
(3)一氧化碳有毒,不能直接排放到空气中,所以该实验设计中的缺点是没有进行尾气处理,改进方法是在 a 处加一盏点燃的酒精灯或套上一个气球。
(4)E 装置中通入的可能是一氧化碳和氧气的混合气体,高温下可能发生爆炸,所以不可以用图示装置替换原装置中的 E 装置。
【拓展应用】由题给信息知,竹炭细密多孔,具有吸附性,可除去口中异味,B 错误。
(1)$\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H}{)}_{2}+\mathrm{C}{\mathrm{O}}_{2}\xlongequal{}\mathrm{C}\mathrm{a}\mathrm{C}{\mathrm{O}}_{3}\downarrow +{\mathrm{H}}_{2}\mathrm{O}$
(2)检验二氧化碳是否已被除尽
(3)没有进行尾气处理 在 a 处加一盏点燃的酒精灯或套上一个气球
(4)不可以 E 装置中通入的气体可能是一氧化碳和氧气的混合气体,加热时可能发生爆炸
【拓展应用】B
【解析】【设计实验】
(1)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水。
(2)A 装置的主要作用是除去空气中的二氧化碳,防止其影响后续检验,故在 A、B 装置间增加装有澄清石灰水的装置,目的是检验二氧化碳是否已被除尽。
(3)一氧化碳有毒,不能直接排放到空气中,所以该实验设计中的缺点是没有进行尾气处理,改进方法是在 a 处加一盏点燃的酒精灯或套上一个气球。
(4)E 装置中通入的可能是一氧化碳和氧气的混合气体,高温下可能发生爆炸,所以不可以用图示装置替换原装置中的 E 装置。
【拓展应用】由题给信息知,竹炭细密多孔,具有吸附性,可除去口中异味,B 错误。
查看更多完整答案,请扫码查看


