6. 实验小组用传感器探究 ${NaOH}$ 溶液与稀盐酸反应过程中温度和 ${pH}$ 的变化,测定结果如图所示。下列说法错误的是(
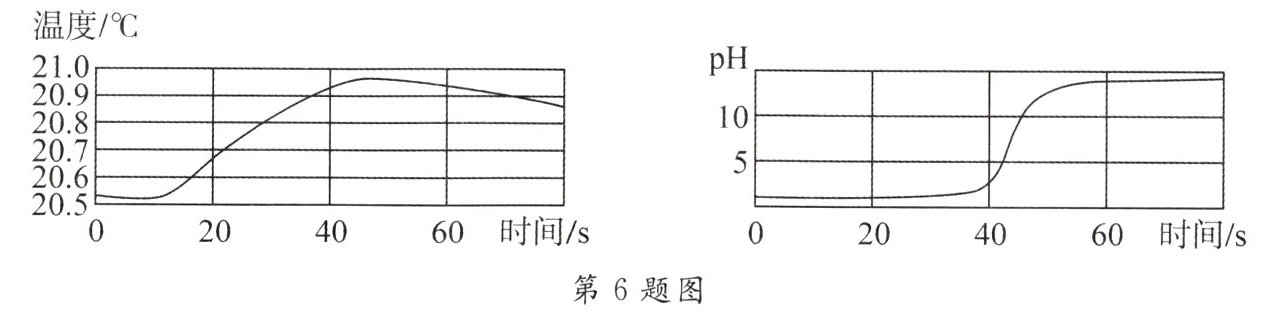
A.反应过程中有热量放出
B.${30s}$ 时,溶液中溶质为 ${HCl}$ 和 ${NaCl}$
C.该实验是将稀盐酸滴入 ${NaOH}$ 溶液
D.从 ${20s}$ 到 ${40s}$,溶液的温度升高,${pH}$ 增大
【思路点拨】本题的难点是图像分析。可以通过分析酸碱中和反应中的能量变化以及酸碱性变化做出判断。氢氧化钠溶液与稀盐酸反应放出热量,两者恰好反应时,溶液呈中性,${pH = 7}$;盐酸过量时,溶液呈酸性,${pH < 7}$;氢氧化钠过量时,溶液呈碱性,${pH > 7}$。
C
)
A.反应过程中有热量放出
B.${30s}$ 时,溶液中溶质为 ${HCl}$ 和 ${NaCl}$
C.该实验是将稀盐酸滴入 ${NaOH}$ 溶液
D.从 ${20s}$ 到 ${40s}$,溶液的温度升高,${pH}$ 增大
【思路点拨】本题的难点是图像分析。可以通过分析酸碱中和反应中的能量变化以及酸碱性变化做出判断。氢氧化钠溶液与稀盐酸反应放出热量,两者恰好反应时,溶液呈中性,${pH = 7}$;盐酸过量时,溶液呈酸性,${pH < 7}$;氢氧化钠过量时,溶液呈碱性,${pH > 7}$。
答案:
C
7. 将 ${5\%}$ 的 ${NaOH}$ 溶液逐滴加入 ${10g}$ 稀盐酸中,边加边搅拌,随着 ${NaOH}$ 溶液加入,溶液 ${pH}$ 的变化如图所示。请回答:
(1)${a}$ 点溶液中大量存在的离子有
(2)当恰好完全反应时,消耗 ${NaOH}$ 溶液的质量为
(3)计算稀盐酸中溶质的质量分数。
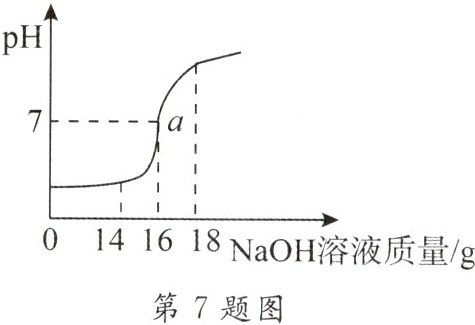
(1)${a}$ 点溶液中大量存在的离子有
Na⁺、Cl⁻
。 (2)当恰好完全反应时,消耗 ${NaOH}$ 溶液的质量为
16g
。 (3)计算稀盐酸中溶质的质量分数。

答案:
Na+、Cl-
16g
解:设稀盐酸中氯化氢的质量为x
$\mathrm {NaOH}+\mathrm {HCl}\xlongequal[\ \ \ \ \ \ ]{}\mathrm {NaCl}+\mathrm {H}_{2}\mathrm {O}$
40 36.5
16g×5% x
$\frac {40}{16\mathrm {g}×5\%}=\frac {36.5}x,$解得$x=0.73\mathrm {g}$
则稀盐酸中溶质的质量分数为$\frac {0.73\mathrm {g}}{10\mathrm {g}}×100\%=7.3\%。$
答:稀盐酸中溶质的质量分数为7.3\%.
16g
解:设稀盐酸中氯化氢的质量为x
$\mathrm {NaOH}+\mathrm {HCl}\xlongequal[\ \ \ \ \ \ ]{}\mathrm {NaCl}+\mathrm {H}_{2}\mathrm {O}$
40 36.5
16g×5% x
$\frac {40}{16\mathrm {g}×5\%}=\frac {36.5}x,$解得$x=0.73\mathrm {g}$
则稀盐酸中溶质的质量分数为$\frac {0.73\mathrm {g}}{10\mathrm {g}}×100\%=7.3\%。$
答:稀盐酸中溶质的质量分数为7.3\%.
查看更多完整答案,请扫码查看


