1. 盐酸、硫酸都是常见的酸,它们都能与酸碱指示剂反应,能与某些金属、金属氧化物反应,也能与一些碱反应,它们具有相似的化学性质,这就是酸的通性。酸具有通性的原因是
它们都含有相同的阳离子——氢离子
。
答案:
它们都含有相同的阳离子——氢离子
2. 将稀硫酸滴入盛有$ BaCl_2 $溶液的试管中,观察到的现象是
产生白色沉淀
,其反应的化学方程式为BaCl₂+H₂SO₄=BaSO₄↓+2HCl
。
答案:
产生白色沉淀 BaCl₂+H₂SO₄=BaSO₄↓+2HCl
3. 浓$ H_2SO_4 $稀释时,要将
浓硫酸
慢慢沿杯壁倒入水
中,不能将水
倒入浓硫酸
中,否则将会使酸液飞溅
,造成危险。衣服、纸张沾到浓硫酸会变焦,是由于浓硫酸有脱水
性;浓硫酸可以干燥$ H_2 或 O_2,$是由于它有吸水
性。
答案:
浓硫酸 水 水 浓硫酸 酸液飞溅 脱水 吸水
4. 如果在使用浓硫酸时,不慎将浓硫酸溅到皮肤上,要先用
干布拭去
,然后再用大量水冲洗
,最后用小苏打
溶液冲洗,严重时应立即送医院治疗。
答案:
干布拭去 大量水冲洗 小苏打
5. 将浓硫酸、浓盐酸敞口放置一段时间,它们的共同变化是(
A.颜色发生改变
B.发生化学变化
C.质量减少
D.溶质的质量分数变小
D
)。A.颜色发生改变
B.发生化学变化
C.质量减少
D.溶质的质量分数变小
答案:
D
6. 往一定量的稀硫酸中加入过量的锌粒,如图是反应过程中某种量 y 随加入锌粒的质量变化的图像。由此可知,y 不可能表示(

A.硫酸的质量分数
B.生成硫酸锌的质量
C.溶液的 pH
D.生成氢气的质量
A
)。
A.硫酸的质量分数
B.生成硫酸锌的质量
C.溶液的 pH
D.生成氢气的质量
答案:
A
7. 如图是为了验证稀硫酸的化学性质所做的三个实验,请回答下列问题。
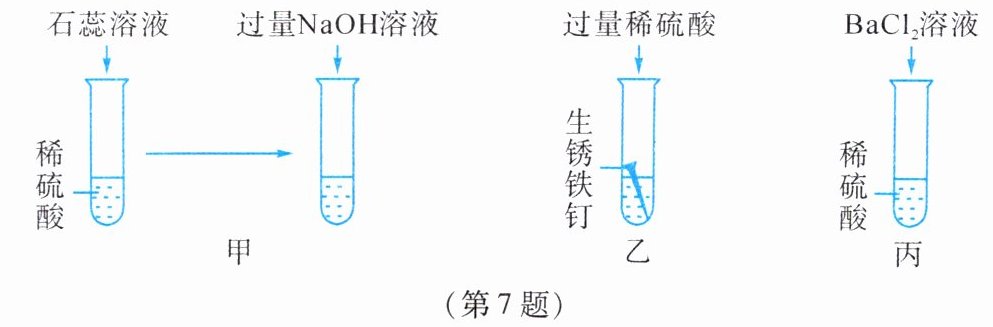
(1)甲实验最终能观察到的现象是
(2)乙实验能体现出稀硫酸具有的化学性质是
(3)欲证明丙实验后硫酸过量,可在试管中加入少量

(1)甲实验最终能观察到的现象是
溶液变蓝
。(2)乙实验能体现出稀硫酸具有的化学性质是
能与金属氧化物和金属反应
。(3)欲证明丙实验后硫酸过量,可在试管中加入少量
BaCl₂溶液
,可观察到的现象是继续生成白色沉淀
。
答案:
(1)溶液变蓝 (2)能与金属氧化物和金属反应 (3)BaCl₂溶液 继续生成白色沉淀
查看更多完整答案,请扫码查看


