第12页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
1.(2024·吉林中考)建设生态文明与美丽中国,合理的垃圾分类、有效的垃圾回收与利用必不可少。下列说法不合理的是( )
A. 废弃塑料回收利用可减少“白色污染”
B. 废弃电池填埋处理会造成土壤污染
C. 废旧金属回收利用能节约金属资源
D. 生活垃圾露天焚烧能保护生态环境
A. 废弃塑料回收利用可减少“白色污染”
B. 废弃电池填埋处理会造成土壤污染
C. 废旧金属回收利用能节约金属资源
D. 生活垃圾露天焚烧能保护生态环境
答案:
D
2. 垃圾被称为“放错了地方的资源”,实践小组的同学们在老师的组织下,带着极大的兴趣对垃圾分类价值、处理方法及宣传活动等方面展开了项目化学习。
任务一:调查垃圾分类的价值
(1)同学们参观了垃圾处理厂、学习垃圾分类方法,将垃圾分类处理后能得到很多可再利用的资源,请将下列废弃物与对应垃圾种类连线。

任务二:学习垃圾分类处理的方法
【参观学习】小组同学在技术人员的指导下,了解到垃圾回收处理的过程如下:分类收集→运输→垃圾处理厂筛分→分类处理→最终处理,垃圾回收后的处理方法大致有:加工后再变成相应的原料、加工处理后可以变成有机肥、拆解提取宝贵的稀有金属等原材料、作为填海、填坑的材料、焚烧发电以及填埋处理等;
(2)你认为学校旧电脑、教学一体机的处理方法是________________________(写一种);
(3)加工处理后可以变成有机肥的垃圾是________(写一种)。
任务三:体验废金属的处理回收
【材料收集】从垃圾处理厂收集带有油污和生锈的钢制废螺丝。
【进行实验】将材料带回实验室,进行了除去废螺丝表面油污和铁锈的实验;
|实验步骤|实验现象|
| ---- | ---- |
|实验一:将废螺丝放入一只烧杯中,向其中倾倒汽油,浸泡一段时间后取出|螺丝表面的油污消失|
|实验二:将去除油污后的螺丝放到另一只烧杯中,向其中倾倒足量稀盐酸,浸泡一段时间后取出|铁锈消失,溶液由无色变为黄色,有气泡产生|
【交流讨论】
(4)实验一中油污消失的原因是________________________;
(5)实验二中产生气泡的化学方程式是________________________;
(6)在钢铁表面涂油、刷漆、可以防止钢铁生锈,其原理是________________________;
(7)回收利用废旧金属的意义是________________________。
任务四:设计垃圾分类回收的宣传活动
同学们通过实地宣讲,拍摄小视频等多种方式,宣传了垃圾分类回收的重要意义。
任务一:调查垃圾分类的价值
(1)同学们参观了垃圾处理厂、学习垃圾分类方法,将垃圾分类处理后能得到很多可再利用的资源,请将下列废弃物与对应垃圾种类连线。

任务二:学习垃圾分类处理的方法
【参观学习】小组同学在技术人员的指导下,了解到垃圾回收处理的过程如下:分类收集→运输→垃圾处理厂筛分→分类处理→最终处理,垃圾回收后的处理方法大致有:加工后再变成相应的原料、加工处理后可以变成有机肥、拆解提取宝贵的稀有金属等原材料、作为填海、填坑的材料、焚烧发电以及填埋处理等;
(2)你认为学校旧电脑、教学一体机的处理方法是________________________(写一种);
(3)加工处理后可以变成有机肥的垃圾是________(写一种)。
任务三:体验废金属的处理回收
【材料收集】从垃圾处理厂收集带有油污和生锈的钢制废螺丝。
【进行实验】将材料带回实验室,进行了除去废螺丝表面油污和铁锈的实验;
|实验步骤|实验现象|
| ---- | ---- |
|实验一:将废螺丝放入一只烧杯中,向其中倾倒汽油,浸泡一段时间后取出|螺丝表面的油污消失|
|实验二:将去除油污后的螺丝放到另一只烧杯中,向其中倾倒足量稀盐酸,浸泡一段时间后取出|铁锈消失,溶液由无色变为黄色,有气泡产生|
【交流讨论】
(4)实验一中油污消失的原因是________________________;
(5)实验二中产生气泡的化学方程式是________________________;
(6)在钢铁表面涂油、刷漆、可以防止钢铁生锈,其原理是________________________;
(7)回收利用废旧金属的意义是________________________。
任务四:设计垃圾分类回收的宣传活动
同学们通过实地宣讲,拍摄小视频等多种方式,宣传了垃圾分类回收的重要意义。
答案:
(1)
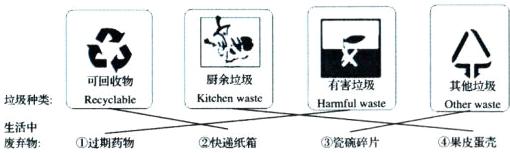
垃圾种类:可回收物Recyclable、厨余垃圾Kitchen waste、有害垃圾Harmful waste、其他垃圾Other waste
生活中废弃物:①过期药物、②快递纸箱、③瓷砖碎片、④果皮蛋壳
(2)拆解提取宝贵的稀有金属等原材料
(3)厨余垃圾
(4)汽油溶解油污
(5)$Fe + 2HCl = FeCl_2 + H_2\uparrow$
(6)使铁与氧气和水隔绝
(7)节约金属资源
(1)

垃圾种类:可回收物Recyclable、厨余垃圾Kitchen waste、有害垃圾Harmful waste、其他垃圾Other waste
生活中废弃物:①过期药物、②快递纸箱、③瓷砖碎片、④果皮蛋壳
(2)拆解提取宝贵的稀有金属等原材料
(3)厨余垃圾
(4)汽油溶解油污
(5)$Fe + 2HCl = FeCl_2 + H_2\uparrow$
(6)使铁与氧气和水隔绝
(7)节约金属资源
3. 据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染,同学们对废旧手机中的金属回收产生兴趣。
【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
①手机电路板中的金属及其价格如表所示:
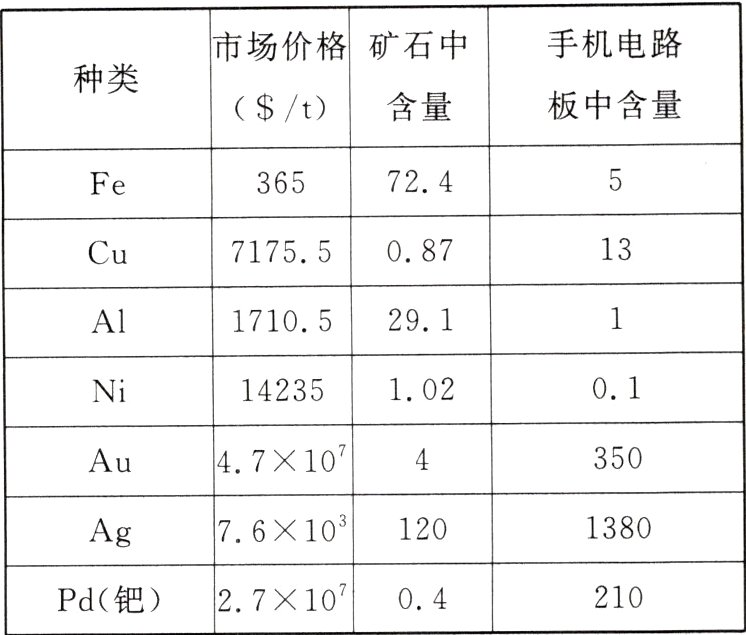
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
②Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;Ni²⁺溶液为绿色。
③在通常情况下,铜不与稀硫酸反应,但在供给充足空气(氧气),并在加热条件下,铜在稀硫酸中能缓慢地减少,生成两种物质:一种能溶解于水的盐;一种氧化物。
【实验方案】
第一步:选择值得回收的金属。
依据资料①中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:
①它们的市场价格较高;
②________________________。
第二步:设计实验,分离、回收部分金属。
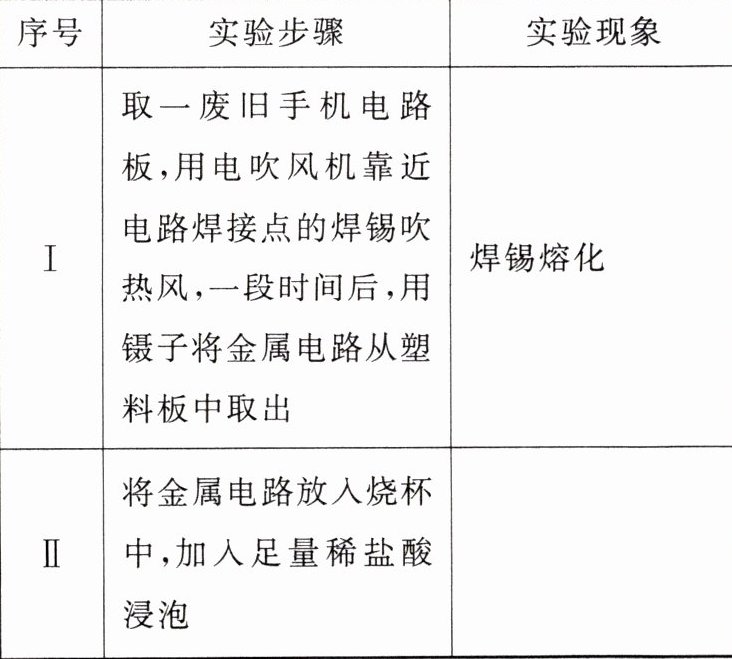

【问题讨论】
(1)由步骤I中的现象,可推知的焊锡的物理性质是________________________。焊锡与锡不同的物理性质还有________________________(写一条即可),请用简单的方法证明:________________________。
(2)步骤II对应的实验现象是________________________。
(3)步骤II所得溶液中,一定含有的金属元素是________。
(4)步骤III中实验结束后溶液变蓝色,请用化学方程式解释:________________________。
(5)步骤V继续对IV的溶液进行处理,请写出具体的操作:________________________,并用化学方程式表示此反应:________________________。
【反思交流】
为了确认步骤IV中滤纸上的金属成分,应进一步查阅的资料为________________________。
【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
①手机电路板中的金属及其价格如表所示:

说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
②Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;Ni²⁺溶液为绿色。
③在通常情况下,铜不与稀硫酸反应,但在供给充足空气(氧气),并在加热条件下,铜在稀硫酸中能缓慢地减少,生成两种物质:一种能溶解于水的盐;一种氧化物。
【实验方案】
第一步:选择值得回收的金属。
依据资料①中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:
①它们的市场价格较高;
②________________________。
第二步:设计实验,分离、回收部分金属。


【问题讨论】
(1)由步骤I中的现象,可推知的焊锡的物理性质是________________________。焊锡与锡不同的物理性质还有________________________(写一条即可),请用简单的方法证明:________________________。
(2)步骤II对应的实验现象是________________________。
(3)步骤II所得溶液中,一定含有的金属元素是________。
(4)步骤III中实验结束后溶液变蓝色,请用化学方程式解释:________________________。
(5)步骤V继续对IV的溶液进行处理,请写出具体的操作:________________________,并用化学方程式表示此反应:________________________。
【反思交流】
为了确认步骤IV中滤纸上的金属成分,应进一步查阅的资料为________________________。
答案:
[实验方案]②它们在手机电路板中的含量高于其在矿石中的含量
[问题讨论]
(1)熔点较低 硬度较大 将两块等大的焊锡片、锡片相互刻画,锡片上有划痕
(2)溶液变成绿色,有气泡产生
(3)Fe、Al、Ni
(4)$2Cu + O_2 + 2H_2SO_4 \stackrel{\triangle}{=} 2CuSO_4 + 2H_2O$
(5)向Ⅳ中得到的滤液中加入足量的铁粉(或镁、锌等),充分反应后过滤
$Fe + CuSO_4 = Cu + FeSO_4$
[反思交流]Au、Ag、Pd在加热条件下,能否与氧气、稀硫酸发生反应(合理即可)
[问题讨论]
(1)熔点较低 硬度较大 将两块等大的焊锡片、锡片相互刻画,锡片上有划痕
(2)溶液变成绿色,有气泡产生
(3)Fe、Al、Ni
(4)$2Cu + O_2 + 2H_2SO_4 \stackrel{\triangle}{=} 2CuSO_4 + 2H_2O$
(5)向Ⅳ中得到的滤液中加入足量的铁粉(或镁、锌等),充分反应后过滤
$Fe + CuSO_4 = Cu + FeSO_4$
[反思交流]Au、Ag、Pd在加热条件下,能否与氧气、稀硫酸发生反应(合理即可)
1. 城市的废旧电器是一座“金属矿山”,某废旧电器中含有锌、铜、镍(Ni)三种金属,兴趣小组的同学为了从中回收金属铜和镍,做了如下探究。
已知:硫酸镍(化学式为NiSO₄)能溶于水。
实验一:探究锌、铜、镍三种金属在溶液中的活动性强弱
【提出猜想】
(1)兴趣小组结合常见金属活动性顺序,提出了以下猜想。
猜想一:Zn>Ni>Cu;猜想二:Zn>Cu>Ni;猜想三:________。
【进行实验】
(2)兴趣小组进行了如下实验,请完成实验报告。
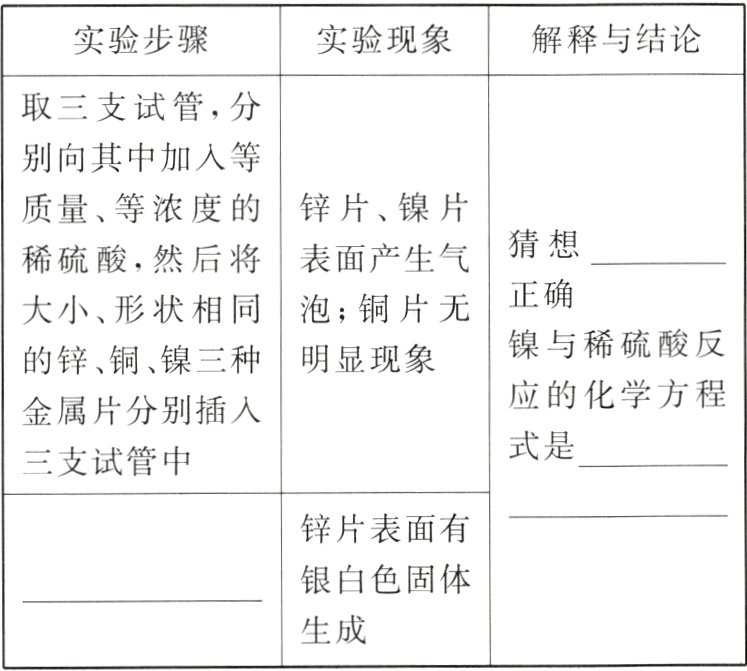
实验二:从含有锌、铜、镍三种金属的废旧电器中回收铜和镍
【设计方案】兴趣小组设计了如图所示的物质转化流程。
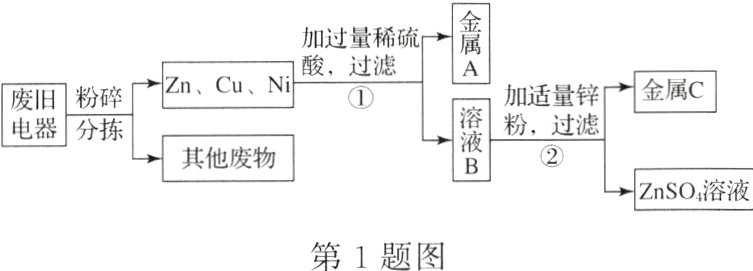
(3)步骤①中得到的A是________;步骤②中生成C的化学方程式是________。
(4)现有n g粉碎分拣后的Zn、Cu、Ni与过量的稀硫酸反应,得到金属A的质量为2 g,则产生氢气的质量范围是________g。
【反思评价】
(5)合理开发城市“金属矿山”的意义是________。
已知:硫酸镍(化学式为NiSO₄)能溶于水。
实验一:探究锌、铜、镍三种金属在溶液中的活动性强弱
【提出猜想】
(1)兴趣小组结合常见金属活动性顺序,提出了以下猜想。
猜想一:Zn>Ni>Cu;猜想二:Zn>Cu>Ni;猜想三:________。
【进行实验】
(2)兴趣小组进行了如下实验,请完成实验报告。

实验二:从含有锌、铜、镍三种金属的废旧电器中回收铜和镍
【设计方案】兴趣小组设计了如图所示的物质转化流程。

(3)步骤①中得到的A是________;步骤②中生成C的化学方程式是________。
(4)现有n g粉碎分拣后的Zn、Cu、Ni与过量的稀硫酸反应,得到金属A的质量为2 g,则产生氢气的质量范围是________g。
【反思评价】
(5)合理开发城市“金属矿山”的意义是________。
答案:
(1)$Ni>Zn>Cu$
(2)将锌片放入硫酸镍溶液中 一
$Ni + H_{2}SO_{4} = NiSO_{4} + H_{2}\uparrow$
(3)$Cu$ $Zn + NiSO_{4} = ZnSO_{4} + Ni$
(4)$\frac{2n - 4}{65} \sim \frac{2n - 4}{59}$
(5)节约金属资源
(1)$Ni>Zn>Cu$
(2)将锌片放入硫酸镍溶液中 一
$Ni + H_{2}SO_{4} = NiSO_{4} + H_{2}\uparrow$
(3)$Cu$ $Zn + NiSO_{4} = ZnSO_{4} + Ni$
(4)$\frac{2n - 4}{65} \sim \frac{2n - 4}{59}$
(5)节约金属资源
2. 新素材 2024年5月3日17时27分,长征五号遥八运载火箭在文昌航天发射场点火升空,成功将嫦娥六号月球探测器送入地月转移轨道,发射任务取得圆满成功。航天兴趣小组的同学去参观了航天展览馆,了解到空间站实验舱使用的太阳能电池中含有铬(Cr)元素;金属银因其高导电性和耐高温性而被广泛应用于制造各种飞机和航天器。同学们欲探究金属铬与铁、银的金属活动性强弱。
【提出假设】
(1)三种金属的活动性顺序分别是:假设1:Cr>Fe>Ag;假设2:Fe>Ag>Cr;假设3:________。
【查阅资料】铬是银白色有光泽的金属,在空气中像铝一样,表面能产生致密的氧化膜。
【实验设计】分别取形状、大小相同的铬、铁、银三种金属片进行下列两组实验。
实验一:将未经打磨的金属片直接放入等质量、等浓度的稀硫酸中。
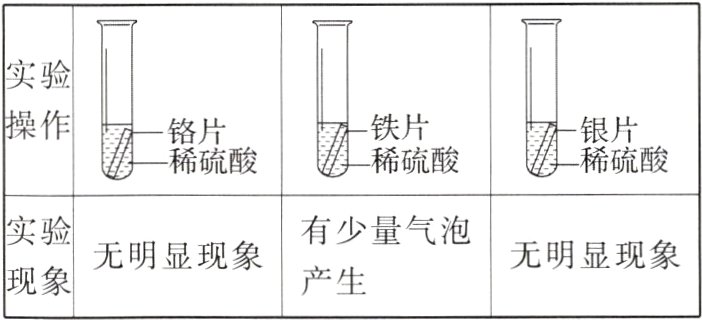
实验二:
(2)先用砂纸打磨金属片,再分别放入等质量、等浓度的稀硫酸中。
|实验现象|产生大量气泡|有少量气泡产生,溶液变为________色|无明显现象|
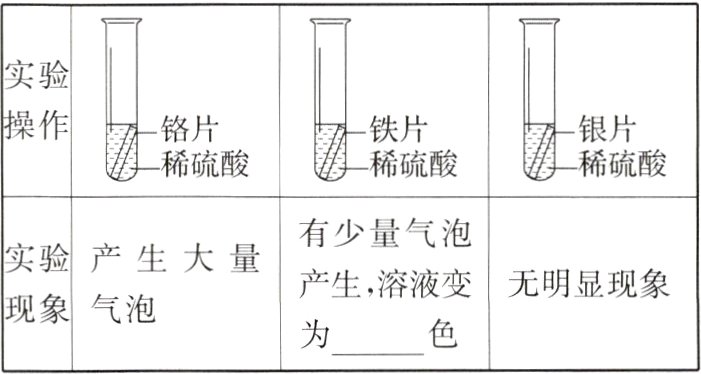
【讨论交流】
(3)同学们发现实验一和实验二中铬片与稀硫酸反应的现象截然不同,出现这种情况的原因是________;铁片与稀硫酸反应的化学方程式为________。
【得出结论】
(4)若想得出正确结论,还需要补充的实验操作是________,经实验,假设1成立。
【实验反思】
(5)小组同学用下列各组物质进行实验,能验证Cr、Fe、Ag三种金属活动性强弱的是________(填字母序号)。
A. Cr、Ag、FeCl₂溶液
B. Ag、FeCl₂溶液、CrSO₄溶液
C. Fe、AgNO₃溶液、CrSO₄溶液
【拓展应用】
(6)向铁片与稀硫酸反应后的溶液中加入一定量的铬,观察到有气泡产生,则原溶液中含有的物质是水和________。
【提出假设】
(1)三种金属的活动性顺序分别是:假设1:Cr>Fe>Ag;假设2:Fe>Ag>Cr;假设3:________。
【查阅资料】铬是银白色有光泽的金属,在空气中像铝一样,表面能产生致密的氧化膜。
【实验设计】分别取形状、大小相同的铬、铁、银三种金属片进行下列两组实验。
实验一:将未经打磨的金属片直接放入等质量、等浓度的稀硫酸中。

实验二:
(2)先用砂纸打磨金属片,再分别放入等质量、等浓度的稀硫酸中。
|实验现象|产生大量气泡|有少量气泡产生,溶液变为________色|无明显现象|

【讨论交流】
(3)同学们发现实验一和实验二中铬片与稀硫酸反应的现象截然不同,出现这种情况的原因是________;铁片与稀硫酸反应的化学方程式为________。
【得出结论】
(4)若想得出正确结论,还需要补充的实验操作是________,经实验,假设1成立。
【实验反思】
(5)小组同学用下列各组物质进行实验,能验证Cr、Fe、Ag三种金属活动性强弱的是________(填字母序号)。
A. Cr、Ag、FeCl₂溶液
B. Ag、FeCl₂溶液、CrSO₄溶液
C. Fe、AgNO₃溶液、CrSO₄溶液
【拓展应用】
(6)向铁片与稀硫酸反应后的溶液中加入一定量的铬,观察到有气泡产生,则原溶液中含有的物质是水和________。
答案:
(1)$Fe>Cr>Ag$
(2)浅绿
(3)铬表面有一层致密的氧化膜
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$
(4)将铬片放入硫酸亚铁溶液中,观察现象
(5)$AC$
(6)硫酸亚铁、硫酸
(1)$Fe>Cr>Ag$
(2)浅绿
(3)铬表面有一层致密的氧化膜
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$
(4)将铬片放入硫酸亚铁溶液中,观察现象
(5)$AC$
(6)硫酸亚铁、硫酸
3. 数字化实验 金属及金属材料广泛应用于生产、生活及科学实验,其应用推动了社会的发展。
探究一:金属生锈的探究
某化学兴趣小组设计了如图甲所示的数字化实验指导同学们对钢铁锈蚀进行探究。用铁粉和碳粉的均匀混合物模拟铁钉成分,用传感器测定试剂瓶内气体的相关数据。
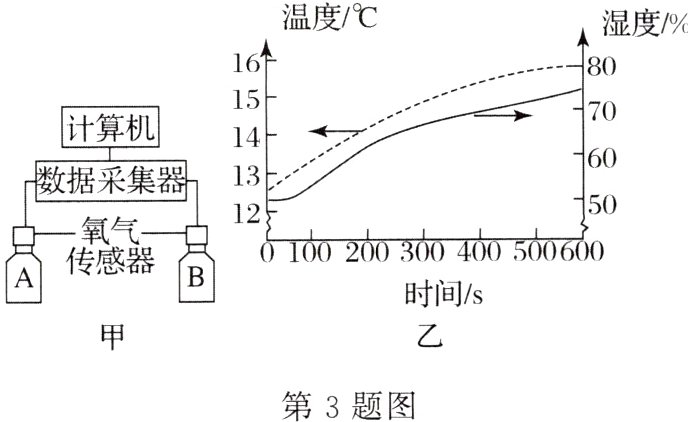
可供选择的药品如下表:
(1)铁在空气中锈蚀生成铁锈,铁锈的主要成分是________(填化学式)。
(2)在A、B两个试剂瓶中依次加入第一组和第二组药品进行实验。
①600 s内A瓶中O₂含量几乎不变,B瓶中不断减少。实验表明,铁在空气中锈蚀是铁和O₂、________发生了化学反应。
②将第二组药品中的水改为迅速冷却的沸水,且用量增多至足以完全浸没固体混合物。600 s内B瓶中O₂含量也略有减少,主要原因是________。
(3)为探究食盐对钢铁锈蚀速率的影响,应选择的药品组别是________。
(4)在两个试剂瓶中均加入第二组药品,分别改用温度和湿度传感器测得结果如图乙所示。瓶内湿度随时间增大(即水蒸气含量增大),根本原因是________。
(5)请提出一种防止钢铁生锈的方法:________(合理即可)。
探究二:从X、银、铜、锌四种金属的混合物中分离某贵重金属。流程如下:

(6)气体Q的化学式为________。
(7)四种金属的活动性顺序由强到弱是________。
(8)滤液A中含有的物质有________种。
(9)写出③中发生反应的化学方程式:________。
探究一:金属生锈的探究
某化学兴趣小组设计了如图甲所示的数字化实验指导同学们对钢铁锈蚀进行探究。用铁粉和碳粉的均匀混合物模拟铁钉成分,用传感器测定试剂瓶内气体的相关数据。

可供选择的药品如下表:
(1)铁在空气中锈蚀生成铁锈,铁锈的主要成分是________(填化学式)。
(2)在A、B两个试剂瓶中依次加入第一组和第二组药品进行实验。
①600 s内A瓶中O₂含量几乎不变,B瓶中不断减少。实验表明,铁在空气中锈蚀是铁和O₂、________发生了化学反应。
②将第二组药品中的水改为迅速冷却的沸水,且用量增多至足以完全浸没固体混合物。600 s内B瓶中O₂含量也略有减少,主要原因是________。
(3)为探究食盐对钢铁锈蚀速率的影响,应选择的药品组别是________。
(4)在两个试剂瓶中均加入第二组药品,分别改用温度和湿度传感器测得结果如图乙所示。瓶内湿度随时间增大(即水蒸气含量增大),根本原因是________。
(5)请提出一种防止钢铁生锈的方法:________(合理即可)。
探究二:从X、银、铜、锌四种金属的混合物中分离某贵重金属。流程如下:

(6)气体Q的化学式为________。
(7)四种金属的活动性顺序由强到弱是________。
(8)滤液A中含有的物质有________种。
(9)写出③中发生反应的化学方程式:________。
答案:
(1)$Fe_{2}O_{3}$
(2)①$H_{2}O$(或水)
②试剂瓶中的$O_{2}$逐渐溶于冷却的沸水
(3)二和三
(4)铁的锈蚀反应有热量放出,瓶内温度上升,水蒸发为水蒸气
(5)钢铁表面覆盖保护层或保持钢铁表面洁净、干燥或制成不锈钢等
(6)$H_{2}$
(7)$Zn>X>Cu>Ag$
(8)4(或四)
(9)$Cu + 2AgNO_{3} = Cu(NO_{3})_{2} + 2Ag$
(1)$Fe_{2}O_{3}$
(2)①$H_{2}O$(或水)
②试剂瓶中的$O_{2}$逐渐溶于冷却的沸水
(3)二和三
(4)铁的锈蚀反应有热量放出,瓶内温度上升,水蒸发为水蒸气
(5)钢铁表面覆盖保护层或保持钢铁表面洁净、干燥或制成不锈钢等
(6)$H_{2}$
(7)$Zn>X>Cu>Ag$
(8)4(或四)
(9)$Cu + 2AgNO_{3} = Cu(NO_{3})_{2} + 2Ag$
1. 常见的金属
(1)铁:(纯铁)是一种______色,有金属光泽,质软的固体,具有良好的延展性,是______的良导体。
(2)铜:是一种______色,有金属光泽,质软的固体,具有良好的延展性,是电和热的良导体。
(3)铝:是一种银白色,有金属光泽,质软的固体,具有良好的延展性,导电性和导热性比较良好。铝______的性能比较好,因为铝在空气中可以形成一层致密的______,阻止内部铝的继续氧化。
(4)钛:是一种银白色,有金属光泽的固体,具有良好的______性,广泛应用于医疗、航天、航空等领域。
答案:
(1)黑 电和热
(2)红
(3)耐腐蚀 氧化膜
(4)耐腐蚀
(1)黑 电和热
(2)红
(3)耐腐蚀 氧化膜
(4)耐腐蚀
2. 合金:由一种______跟其他一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质。一定是______物。常见的合金:铜合金、铁合金、铝合金。
3. 合金的优点:合金比纯金属的熔点______,硬度______,抗腐蚀性能______。
答案:
2. 金属 混合 3. 降低 增强 增强
查看更多完整答案,请扫码查看


