2025年诚成教育学业评价九年级化学下册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年诚成教育学业评价九年级化学下册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
26.(2023.泸水三模)在“探究酸、碱的化学性质”实验课上,某同学向盛有约$2mL$氢氧化钠溶液的试管中滴加稀硫酸,没有观察到现象。请教老师后,他发现自己在滴加稀硫酸前忘了加入酸碱指示剂,导致无法判断反应情况。于是他对试管中发生中和反应的反应程度进行探究。
[实验目的]探究试管中发生中和反应的反应程度。
[实验原理](1)试管中发生反应的化学方程式为______________________________。
[作出猜想]
猜想1:氢氧化钠未完全反应,溶液呈碱性。
猜想2:氢氧化钠和硫酸恰好完全反应,溶液呈中性。
猜想3:氢氧化钠完全反应、硫酸过量,溶液呈酸性。

[进行实验]
|实验操作|实验现象|实验结论|
$|----|----|----|$
|取该溶液$1~2mL$于试管中,滴入1~2滴无色酚酞溶液,振荡|溶液变$(2)______|$溶液呈碱性|
| |溶液不变色|溶液呈$(3)______|$
[分析思考]
(4)若滴入酚酞后溶液不变色,为进一步确定溶液的酸碱性,该同学提出了以下方案:
|方案1|用$pH$试纸测其酸碱度,若$pH______($填“>”“<”或$“=”)7$,则溶液呈酸性|
|方案2|加入金属锌,若有气泡产生,则溶液呈酸性,该反应的化学方程式为$____________________________|$
[实验目的]探究试管中发生中和反应的反应程度。
[实验原理](1)试管中发生反应的化学方程式为______________________________。
[作出猜想]
猜想1:氢氧化钠未完全反应,溶液呈碱性。
猜想2:氢氧化钠和硫酸恰好完全反应,溶液呈中性。
猜想3:氢氧化钠完全反应、硫酸过量,溶液呈酸性。

[进行实验]
|实验操作|实验现象|实验结论|
$|----|----|----|$
|取该溶液$1~2mL$于试管中,滴入1~2滴无色酚酞溶液,振荡|溶液变$(2)______|$溶液呈碱性|
| |溶液不变色|溶液呈$(3)______|$
[分析思考]
(4)若滴入酚酞后溶液不变色,为进一步确定溶液的酸碱性,该同学提出了以下方案:
|方案1|用$pH$试纸测其酸碱度,若$pH______($填“>”“<”或$“=”)7$,则溶液呈酸性|
|方案2|加入金属锌,若有气泡产生,则溶液呈酸性,该反应的化学方程式为$____________________________|$
答案:
(1)$2\text{NaOH} + \text{H}_{2}\text{SO}_{4} = \text{Na}_{2}\text{SO}_{4} + 2\text{H}_{2}O$
(2)红色
(3)酸性或中性
(4)$<$ $\text{Zn} + \text{H}_{2}\text{SO}_{4} = \text{ZnSO}_{4} + \text{H}_{2}\uparrow$
(1)$2\text{NaOH} + \text{H}_{2}\text{SO}_{4} = \text{Na}_{2}\text{SO}_{4} + 2\text{H}_{2}O$
(2)红色
(3)酸性或中性
(4)$<$ $\text{Zn} + \text{H}_{2}\text{SO}_{4} = \text{ZnSO}_{4} + \text{H}_{2}\uparrow$
27.(2023.自贡)1921年,正在美国留学的侯德榜先生为了发展我国的民族工业毅然回国,其“侯氏制碱法”为我国纯碱和氮肥工业技术的发展作出了杰出贡献。工业纯碱中可能混有少量$NaCl$,某化学兴趣小组对工业纯碱样品展开探究。
[探究一$]:$确定纯碱样品中是否含有$NaCl$。
(1)取样品加水溶解,加入过量稀硝酸,观察到实验现象:有________产生。
(2)取上述溶液,继续滴加适量$AgNO₃$溶液,观察到实验现象:有________产生。
[结论$]:$样品中含有$NaCl$。
(3)甲、乙、丙三个同学分别用以下药品代替稀硝酸进行(1)步实验,也能确定样品中是否含有$NaCl$的是________(填“甲”“乙”或“丙$”)$。
甲$:CaCl₂$溶液 乙:稀盐酸 丙$:Ba(NO₃)₂$溶液
[探究二$]:$测定纯碱样品中$Na₂CO₃$的质量分数。
(4)兴趣小组设计了以下两个测定方案:
方案一:将样品溶解,加入过量$CaCl₂$溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量,计算$Na₂CO₃$的质量分数。
方案二:如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据球形干燥管的增重计算$Na₂CO₃$的质量分数。

[讨论]
①上述两个方案中,你认为方案________更优。
②方案二锥形瓶内发生反应的化学方程式为____________________。
[探究三$]:$确定$Na₂CO₃$溶液的酸碱性。
(5)向$Na₂CO₃$溶液中滴加酚酞,溶液变成红色,所以溶液呈______性。
[知识拓展](6)纯碱属于______(填“酸”“碱”或“盐$”)$。
[探究一$]:$确定纯碱样品中是否含有$NaCl$。
(1)取样品加水溶解,加入过量稀硝酸,观察到实验现象:有________产生。
(2)取上述溶液,继续滴加适量$AgNO₃$溶液,观察到实验现象:有________产生。
[结论$]:$样品中含有$NaCl$。
(3)甲、乙、丙三个同学分别用以下药品代替稀硝酸进行(1)步实验,也能确定样品中是否含有$NaCl$的是________(填“甲”“乙”或“丙$”)$。
甲$:CaCl₂$溶液 乙:稀盐酸 丙$:Ba(NO₃)₂$溶液
[探究二$]:$测定纯碱样品中$Na₂CO₃$的质量分数。
(4)兴趣小组设计了以下两个测定方案:
方案一:将样品溶解,加入过量$CaCl₂$溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量,计算$Na₂CO₃$的质量分数。
方案二:如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据球形干燥管的增重计算$Na₂CO₃$的质量分数。

[讨论]
①上述两个方案中,你认为方案________更优。
②方案二锥形瓶内发生反应的化学方程式为____________________。
[探究三$]:$确定$Na₂CO₃$溶液的酸碱性。
(5)向$Na₂CO₃$溶液中滴加酚酞,溶液变成红色,所以溶液呈______性。
[知识拓展](6)纯碱属于______(填“酸”“碱”或“盐$”)$。
答案:
(1)气泡
(2)白色沉淀
(3)丙
(4)①一
②$\text{Na}_{2}\text{CO}_{3} + 2\text{HCl} = 2\text{NaCl} + \text{H}_{2}O + \text{CO}_{2}\uparrow$
(5)碱
(6)盐
(1)气泡
(2)白色沉淀
(3)丙
(4)①一
②$\text{Na}_{2}\text{CO}_{3} + 2\text{HCl} = 2\text{NaCl} + \text{H}_{2}O + \text{CO}_{2}\uparrow$
(5)碱
(6)盐
四、计算题(本题1小题,共8分)
28.(2023.衡阳)在一定条件下通过化学反应可以实现物质的转化。甲、乙两位同学为了探索硫酸铜的转化规律,分别将相同浓度的硫酸铜溶液逐滴加入到一定量的氢氧化钠溶液和氯化钡溶液中。
(1)甲同学证明硫酸铜可以转化为氢氧化铜,其实验现象是______________
(2)乙同学证明硫酸铜可以转化为硫酸钡。测得的数据如图所示,请计算硫酸铜溶液的溶质质量分数。
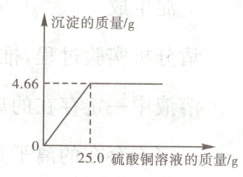
28.(2023.衡阳)在一定条件下通过化学反应可以实现物质的转化。甲、乙两位同学为了探索硫酸铜的转化规律,分别将相同浓度的硫酸铜溶液逐滴加入到一定量的氢氧化钠溶液和氯化钡溶液中。
(1)甲同学证明硫酸铜可以转化为氢氧化铜,其实验现象是______________
(2)乙同学证明硫酸铜可以转化为硫酸钡。测得的数据如图所示,请计算硫酸铜溶液的溶质质量分数。

答案:
(1)有蓝色沉淀生成
(2)解:设参与反应的硫酸铜的质量为$x$。
$\text{BaCl}_{2} + \text{CuSO}_{4} = \text{BaSO}_{4}\downarrow + \text{CuCl}_{2}$
160 233
$x$ 4.66 g
$\frac{160}{233} = \frac{x}{4.66 g}$
解得$x = 3.2 g$
硫酸铜溶液的溶质质量分数为
$\frac{3.2 g}{25.0 g}×100\% = 12.8\%$
答:硫酸铜溶液的溶质质量分数为12.8%。
(1)有蓝色沉淀生成
(2)解:设参与反应的硫酸铜的质量为$x$。
$\text{BaCl}_{2} + \text{CuSO}_{4} = \text{BaSO}_{4}\downarrow + \text{CuCl}_{2}$
160 233
$x$ 4.66 g
$\frac{160}{233} = \frac{x}{4.66 g}$
解得$x = 3.2 g$
硫酸铜溶液的溶质质量分数为
$\frac{3.2 g}{25.0 g}×100\% = 12.8\%$
答:硫酸铜溶液的溶质质量分数为12.8%。
查看更多完整答案,请扫码查看


