2025年诚成教育学业评价九年级化学下册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年诚成教育学业评价九年级化学下册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第11页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
$12.(2023·$随州)列表法和作图法是常用的数据处理方法。请根据下列图表进行分析:
三种物质在不同温度时的溶解度

$(1)Ca(OH)₂$的溶解度随温度的升高而______(填“增大”或“减小$”)$。
$(2)10℃$时,$KNO₃$的溶解度______(填“>”“<”或$“=”)NaCl$的溶解度。
$(3)t℃$时,将75 $gKNO₃$的饱和溶液稀释成溶质质量分数为25%的溶液,需加水的质量为$______g$。
三种物质在不同温度时的溶解度

$(1)Ca(OH)₂$的溶解度随温度的升高而______(填“增大”或“减小$”)$。
$(2)10℃$时,$KNO₃$的溶解度______(填“>”“<”或$“=”)NaCl$的溶解度。
$(3)t℃$时,将75 $gKNO₃$的饱和溶液稀释成溶质质量分数为25%的溶液,需加水的质量为$______g$。
答案:
(1)减小
(2)<
(3)25
(1)减小
(2)<
(3)25
13.(2023·宁夏)如图是A、B两种固体物质(均不含结晶水)的溶解度曲线。
(1)从图中你能获得哪些信息:______(写一条)。
(2)实验室要配制一定溶质质量分数的A溶液,主要涉及以下操作:①溶解;②计算;③称量、量取。正确的操作顺序是______(填序号)。
(3)在20℃时,将B物质的100 g饱和溶液蒸发掉50 g水,析出B的质量是______g。
(4)t₂℃时,接近饱和的B溶液中混有少量的A物质,可采用______的方法得到较纯净的B晶体。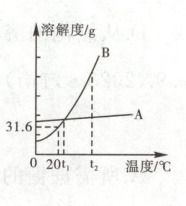
(1)从图中你能获得哪些信息:______(写一条)。
(2)实验室要配制一定溶质质量分数的A溶液,主要涉及以下操作:①溶解;②计算;③称量、量取。正确的操作顺序是______(填序号)。
(3)在20℃时,将B物质的100 g饱和溶液蒸发掉50 g水,析出B的质量是______g。
(4)t₂℃时,接近饱和的B溶液中混有少量的A物质,可采用______的方法得到较纯净的B晶体。

答案:
(1)20℃时,B的溶解度是31.6g(或在$t_{1}$℃时,A和B两种物质的溶解度相等,合理即可)
(2)②③①
(3)15.8
(4)降温结晶
(1)20℃时,B的溶解度是31.6g(或在$t_{1}$℃时,A和B两种物质的溶解度相等,合理即可)
(2)②③①
(3)15.8
(4)降温结晶
14.(2023·铁锋区二模)如图是a、b、c三种物质的溶解度曲线,请根据该图回答下列问题。
(1)P点表示的意义是______。
(2)若b物质中含有少量a物质,可采用______(填“降温结晶”或“蒸发结晶”)的方法提纯b。
(3)t₂℃时,将30 g a物质加入50 g水中,充分溶解,所得溶液为______(填“饱和”或“不饱和”,下同)溶液,再向上述溶液中加入10 g水,充分混合得到的溶液为______溶液。
(4)将t₂℃时等质量的a、b、c三种物质的饱和溶液降温至t₁℃,所得溶液中溶剂质量由大到小的顺序是______。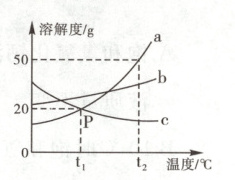
(1)P点表示的意义是______。
(2)若b物质中含有少量a物质,可采用______(填“降温结晶”或“蒸发结晶”)的方法提纯b。
(3)t₂℃时,将30 g a物质加入50 g水中,充分溶解,所得溶液为______(填“饱和”或“不饱和”,下同)溶液,再向上述溶液中加入10 g水,充分混合得到的溶液为______溶液。
(4)将t₂℃时等质量的a、b、c三种物质的饱和溶液降温至t₁℃,所得溶液中溶剂质量由大到小的顺序是______。

答案:
(1)$t_{1}$℃时,a、c两物质溶解度相等,均为20g
(2)蒸发结晶
(3)饱和 饱和
(4)c>b>a(或c、b、a)
(1)$t_{1}$℃时,a、c两物质溶解度相等,均为20g
(2)蒸发结晶
(3)饱和 饱和
(4)c>b>a(或c、b、a)
$15.(2023·$衡水桃城模拟)实验室需要配制15%的氯化钠溶液50 $g$。
(1)计算:需要氯化钠的质量为______。
(2)某同学按下图所示步骤依次操作,其中操作错误的步骤是______(填字母);$E$中玻璃棒的作用是______。
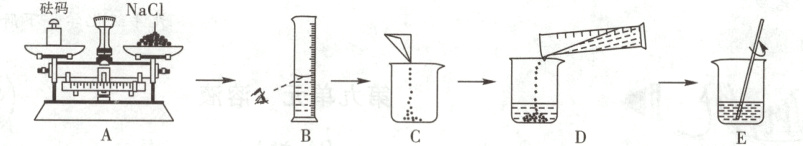
(3)量取所需水时应选用$______mL$量筒(填“10”“50”或$“100”)$;把上述配制好的溶液装入______(填“广口瓶”或“细口瓶$”)$中,盖好瓶塞并贴上标签。
(4)若量取水时仰视读数,则配制的溶液的溶质质量分数会______(填“偏大”“偏小”或“无影响$”)$。
(1)计算:需要氯化钠的质量为______。
(2)某同学按下图所示步骤依次操作,其中操作错误的步骤是______(填字母);$E$中玻璃棒的作用是______。

(3)量取所需水时应选用$______mL$量筒(填“10”“50”或$“100”)$;把上述配制好的溶液装入______(填“广口瓶”或“细口瓶$”)$中,盖好瓶塞并贴上标签。
(4)若量取水时仰视读数,则配制的溶液的溶质质量分数会______(填“偏大”“偏小”或“无影响$”)$。
答案:
(1)7.5g
(2)ABD 搅拌,加速溶解
(3)50 细口瓶
(4)偏小
(1)7.5g
(2)ABD 搅拌,加速溶解
(3)50 细口瓶
(4)偏小
16.(提升练$)(2022·$郴州)下表是$NaCl$、$NH₄Cl$的部分溶解度数据,请按要求回答下列问题。

$(1)NaCl$、$NH₄Cl$两种固体物质的溶解度曲线如右图所示,结合上表数据,则$NH₄Cl$固体的溶解度曲线是______(填$“a”$或$“b”)$。
(2)参照上表数据,交点$M$的取值范围正确的是______(填字母)。

$A.10℃~20℃$ $B.40℃~50℃$
$C.33.3$ $g~35.8$ $g$ $D.35.8$ $g~36.0$ $g$
$(3)50℃$时,$NaCl$的溶解度是$______g$,在此温度下,取20 $gNaCl$固体放入50 $g$水里,充分搅拌后,该溶液中溶质的质量分数是______(结果取整数)。

$(1)NaCl$、$NH₄Cl$两种固体物质的溶解度曲线如右图所示,结合上表数据,则$NH₄Cl$固体的溶解度曲线是______(填$“a”$或$“b”)$。
(2)参照上表数据,交点$M$的取值范围正确的是______(填字母)。

$A.10℃~20℃$ $B.40℃~50℃$
$C.33.3$ $g~35.8$ $g$ $D.35.8$ $g~36.0$ $g$
$(3)50℃$时,$NaCl$的溶解度是$______g$,在此温度下,取20 $gNaCl$固体放入50 $g$水里,充分搅拌后,该溶液中溶质的质量分数是______(结果取整数)。
答案:
(1)a
(2)AD
(3)37.0 27%
(1)a
(2)AD
(3)37.0 27%
四、计算题(本题1小题,共9分)
17.(2023·龙沙区期末)实验室用13 g锌与100 g稀硫酸恰好完全反应,请计算:
(1)生成氢气的质量。
(2)稀硫酸的溶质质量分数。
(3)反应后所得溶液的溶质质量分数。(结果保留0.1%)
17.(2023·龙沙区期末)实验室用13 g锌与100 g稀硫酸恰好完全反应,请计算:
(1)生成氢气的质量。
(2)稀硫酸的溶质质量分数。
(3)反应后所得溶液的溶质质量分数。(结果保留0.1%)
答案:
(1)解:设生成氢气的质量为x,硫酸的质量为y,硫酸锌的质量为z。
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}\uparrow$
65 98 161 2
13g y z x
$\frac{65}{2}=\frac{13g}{x}$ $x = 0.4g$
$\frac{65}{98}=\frac{13g}{y}$ $y = 19.6g$
$\frac{65}{161}=\frac{13g}{z}$ $z = 32.2g$
(2)$\frac{19.6g}{100g}\times100\% = 19.6\%$
(3)$\frac{32.2g}{100g + 13g - 0.4g}\times100\% = 28.6\%$
答:生成氢气的质量为0.4g;稀硫酸的溶质质量分数为19.6%,反应后所得溶液的溶质质量分数为28.6%。
(1)解:设生成氢气的质量为x,硫酸的质量为y,硫酸锌的质量为z。
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}\uparrow$
65 98 161 2
13g y z x
$\frac{65}{2}=\frac{13g}{x}$ $x = 0.4g$
$\frac{65}{98}=\frac{13g}{y}$ $y = 19.6g$
$\frac{65}{161}=\frac{13g}{z}$ $z = 32.2g$
(2)$\frac{19.6g}{100g}\times100\% = 19.6\%$
(3)$\frac{32.2g}{100g + 13g - 0.4g}\times100\% = 28.6\%$
答:生成氢气的质量为0.4g;稀硫酸的溶质质量分数为19.6%,反应后所得溶液的溶质质量分数为28.6%。
查看更多完整答案,请扫码查看


