2025年成才之路高中新课程学习指导高中化学选择性必修2人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年成才之路高中新课程学习指导高中化学选择性必修2人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第77页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
2. 硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
答案:
硫化氢晶体中只存在范德华力,属于分子密堆积,而冰中主要作用力是氢键,氢键具有方向性,氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
1. 北京2022年冬奥会采用$CO_{2}$临界直冷技术,实现“水立方”变为“冰立方”。干冰晶胞如图所示。下列说法错误的是( )
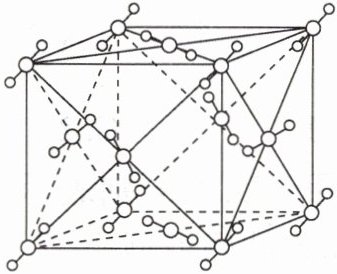
A. 冰、干冰晶体类型不同
B. “水立方”变为“冰立方”,密度减小
C. 用干冰制冷比用氟利昂制冷环保
D. 1个干冰晶胞的质量约为$\frac{176}{6.02×10^{23}}g$

A. 冰、干冰晶体类型不同
B. “水立方”变为“冰立方”,密度减小
C. 用干冰制冷比用氟利昂制冷环保
D. 1个干冰晶胞的质量约为$\frac{176}{6.02×10^{23}}g$
答案:
A@@冰、干冰都属于分子晶体,A项错误;在冰晶体中,每个水分子周围只有四个紧邻的水分子,由于水分子之间的主要作用力为氢键,而氢键具有饱和性和方向性,所以氢键的存在使四面体中心的水分子与四面体顶角方向的4个紧邻水分子相互作用,这一排列使冰晶体中水分子的空间利用率不高,留有相当大的空隙,使得冰的密度比液态水的小,故“水立方”变为“冰立方”,密度减小,B项正确;氟利昂排放到大气中会破坏O₃层,干冰不能破坏O₃层,氟利昂的温室效应是二氧化碳的3 400~15 000倍,故用干冰制冷比用氟利昂制冷环保,C项正确;由干冰的晶胞可知,1个晶胞中含CO₂的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则1个干冰晶胞的质量约为$\frac{4×44}{6.02×10^{23}}$g=$\frac{176}{6.02×10^{23}}$g,D项正确。故选A。
2. 下列有关冰和干冰的叙述不正确的是( )
A. 干冰和冰都是由分子密堆积形成的晶体
B. 冰中存在氢键,每个水分子周围有4个紧邻的水分子
C. 干冰比冰的熔点低,常压下易升华
D. 干冰中只存在范德华力不存在氢键
A. 干冰和冰都是由分子密堆积形成的晶体
B. 冰中存在氢键,每个水分子周围有4个紧邻的水分子
C. 干冰比冰的熔点低,常压下易升华
D. 干冰中只存在范德华力不存在氢键
答案:
A@@干冰是分子密堆积形成的晶体,冰晶体中水分子间采取非紧密堆积的方式,不都是分子密堆积形成的晶体,A错误;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性,故每个水分子周围只有4个紧邻的水分子,B正确;干冰熔化只需克服范德华力,冰熔化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华,C正确;干冰晶体中CO₂分子间作用力只是范德华力,不存在氢键也不能形成氢键,D正确。故选A。
1. 下列有关分子晶体的说法中,正确的是 ( )
A. 分子晶体中分子间作用力越大,分子越稳定
B. 分子晶体中,共价键越强,键能越大,熔点越高
C. 冰融化时水分子间的共价键发生断裂
D. 在冰的晶体结构中由于氢键的存在,其熔点较高
A. 分子晶体中分子间作用力越大,分子越稳定
B. 分子晶体中,共价键越强,键能越大,熔点越高
C. 冰融化时水分子间的共价键发生断裂
D. 在冰的晶体结构中由于氢键的存在,其熔点较高
答案:
D
2. 下列有关分子晶体的叙述正确的是 ( )
A. 分子内均存在共价键
B. 分子晶体的熔点较高
C. 分子晶体中一定存在氢键
D. 分子晶体熔化时一定破坏了范德华力
A. 分子内均存在共价键
B. 分子晶体的熔点较高
C. 分子晶体中一定存在氢键
D. 分子晶体熔化时一定破坏了范德华力
答案:
D
3. 干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较正确的是 ( )
A. 晶体的熔点:干冰 > 冰
B. 晶体中的空间利用率:干冰 > 冰
C. 晶体中分子间相互作用力相同
D. 晶体中键的极性和分子的极性相同
A. 晶体的熔点:干冰 > 冰
B. 晶体中的空间利用率:干冰 > 冰
C. 晶体中分子间相互作用力相同
D. 晶体中键的极性和分子的极性相同
答案:
B
4. 下列说法正确的是 ( )
A. 范德华力普遍存在于分子之间,如液态水中因范德华力的存在使水分子发生缔合
B. $H_{2}SO_{4}$为强电解质,硫酸晶体是能导电的
C. 冰中 1 个 $H_{2}O$ 分子可通过氢键与 4 个水分子相连,所以冰中 $H_{2}O$ 分子与氢键的数目之比为 1 : 4
D. 氢键有饱和性和方向性,所以液态水结成冰时体积会变大
A. 范德华力普遍存在于分子之间,如液态水中因范德华力的存在使水分子发生缔合
B. $H_{2}SO_{4}$为强电解质,硫酸晶体是能导电的
C. 冰中 1 个 $H_{2}O$ 分子可通过氢键与 4 个水分子相连,所以冰中 $H_{2}O$ 分子与氢键的数目之比为 1 : 4
D. 氢键有饱和性和方向性,所以液态水结成冰时体积会变大
答案:
D
查看更多完整答案,请扫码查看


