2025年成才之路高中新课程学习指导高中化学选择性必修2人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年成才之路高中新课程学习指导高中化学选择性必修2人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
1.下列关于元素第一电离能的说法不正确的是 ( A )
A.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
B.对于同一元素而言,原子的电离能I₁<I₂<I₃…
C.外围电子排布为ns²np⁶(当只有K层时为1s²)的原子,第一电离能较大
D.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
A.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
B.对于同一元素而言,原子的电离能I₁<I₂<I₃…
C.外围电子排布为ns²np⁶(当只有K层时为1s²)的原子,第一电离能较大
D.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
答案:
A
2.下列叙述中正确的是 ( )
A.同一周期中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越难失去电子
C.室温时,0族元素的单质都是气体
D.同一周期中,碱金属元素的第一电离能最大
A.同一周期中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越难失去电子
C.室温时,0族元素的单质都是气体
D.同一周期中,碱金属元素的第一电离能最大
答案:
C
3.下列状态的镁中,电离最外层一个电子所需能量最大的是 ( )
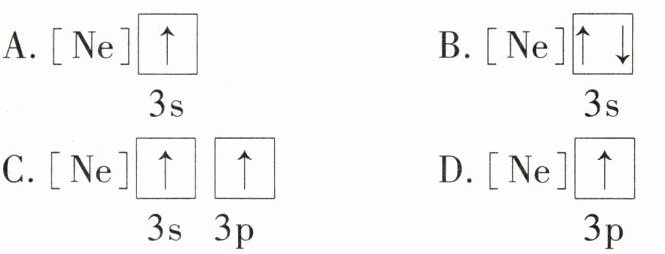

答案:
A
1.有关概念与意义
(1)键合电子:元素相互化合时,原子中用于形成 化学键 的电子。
(2)电负性:用来描述不同元素的原子对键合电子 吸引力 的大小。电负性越大的原子,对键合电子的吸引力 越大 。
(3)电负性大小的标准:以氟的电负性为 4.0 和锂的电负性为 1.0 作为相对标准。
(1)键合电子:元素相互化合时,原子中用于形成 化学键 的电子。
(2)电负性:用来描述不同元素的原子对键合电子 吸引力 的大小。电负性越大的原子,对键合电子的吸引力 越大 。
(3)电负性大小的标准:以氟的电负性为 4.0 和锂的电负性为 1.0 作为相对标准。
答案:
化学键@@吸引力@@越大@@4.0@@1.0
2.递变规律
(1)同周期元素从左到右,元素的电负性逐渐 增大 ,元素的非金属性逐渐 增强 、金属性逐渐 减弱 。
(2)同族元素从上到下,元素的电负性逐渐 减小 ,元素的金属性逐渐 增强 、非金属性逐渐 减弱 。
(1)同周期元素从左到右,元素的电负性逐渐 增大 ,元素的非金属性逐渐 增强 、金属性逐渐 减弱 。
(2)同族元素从上到下,元素的电负性逐渐 减小 ,元素的金属性逐渐 增强 、非金属性逐渐 减弱 。
答案:
变大@@增强@@减弱@@变小@@增强@@减弱
3.应用
(1)判断元素的金属性和非金属性强弱
①金属元素的电负性一般 小于 1.8,非金属元素的电负性一般 大于 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在 1.8左右 ,它们既有金属性,又有非金属性。
②金属元素的电负性 越小 ,金属元素越活泼;非金属元素的电负性 越大 ,非金属元素越活泼。
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力 弱 ,元素的化合价为正值。
②电负性数值大的元素在化合物中吸引电子的能力 强 ,元素的化合价为负值。
(3)判断化合物的类型
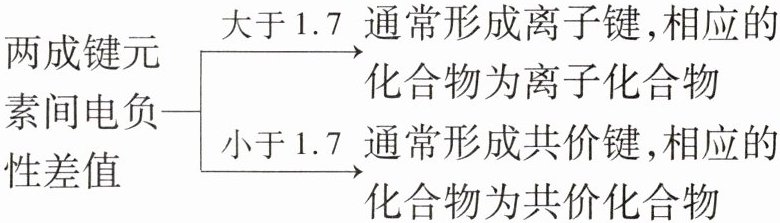
(1)判断元素的金属性和非金属性强弱
①金属元素的电负性一般 小于 1.8,非金属元素的电负性一般 大于 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在 1.8左右 ,它们既有金属性,又有非金属性。
②金属元素的电负性 越小 ,金属元素越活泼;非金属元素的电负性 越大 ,非金属元素越活泼。
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力 弱 ,元素的化合价为正值。
②电负性数值大的元素在化合物中吸引电子的能力 强 ,元素的化合价为负值。
(3)判断化合物的类型

答案:
小于@@大于@@1.8左右@@越小@@越大@@弱@@强
查看更多完整答案,请扫码查看


