2026年高考基础卷高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考基础卷高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第55页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
15.(14 分)1,3 - 丁二烯( )是石油化学工业的重要原料,可用于生产橡胶、塑料和树脂等产品。回答下列问题:
)是石油化学工业的重要原料,可用于生产橡胶、塑料和树脂等产品。回答下列问题:
(1)1,3 - 丁二烯可通过 1 - 丁烯( )直接脱氢制备(方法一),
)直接脱氢制备(方法一),
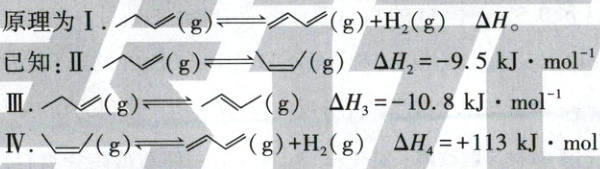
① $ \Delta H = $
② 3 种丁烯的稳定性由弱到强的关系为
(2)向容器中充入 1 - 丁烯只发生反应 I,在 0.1 MPa、0.2 MPa、0.3 MPa 和 0.4 MPa 压强下,1 - 丁烯平衡转化率 $ (\alpha) $ 随温度的变化如图所示。
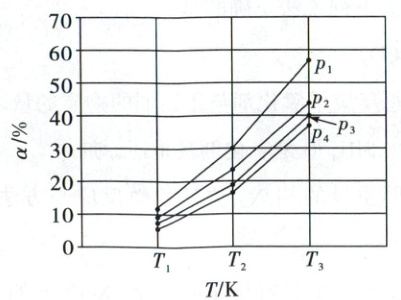
① $ p_{1} = $
② $ T_{3}\ {K} $、$ p_{3} $ 压强下,反应 I 的平衡常数 $ K_{p} = $
(3)1,3 - 丁二烯也可通过 $ {CO_{2}} $ 氧化 1 - 丁烯脱氢制备(方法二),反应分两步,分别为反应 I 和反应 V [反应 V:$ {CO_{2}(g) + H_{2}(g)⇌ CO(g) + H_{2}O(g)} $ $ \Delta H_{5} = +41\ {kJ· mol^{-1}} $ ]。其他条件相同时,方法二中 1 - 丁烯平衡转化率远大于方法一,利用勒夏特列原理解释,引入 $ {CO_{2}} $ 可增大 1 - 丁烯平衡转化率的原因:
(4)方法二制备 1,3 - 丁二烯往往伴随副反应,如反应 II 和 III。一定温度和压强下,为了提高反应速率和 1,3 - 丁二烯选择性,应当
 )是石油化学工业的重要原料,可用于生产橡胶、塑料和树脂等产品。回答下列问题:
)是石油化学工业的重要原料,可用于生产橡胶、塑料和树脂等产品。回答下列问题:(1)1,3 - 丁二烯可通过 1 - 丁烯(
 )直接脱氢制备(方法一),
)直接脱氢制备(方法一),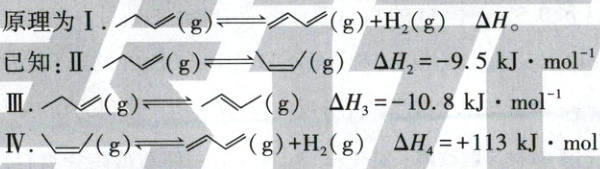
① $ \Delta H = $
+103.5
$ {kJ· mol^{-1}} $,已知 298 K 时反应 I 的 $ \Delta S = +104\ {J· K^{-1}· mol^{-1}} $,反应 I 在 $ 25^{\circ}C $(298 K)时 不能
(填“能”或“不能”)自发进行。② 3 种丁烯的稳定性由弱到强的关系为
〜<〜<〜
。(2)向容器中充入 1 - 丁烯只发生反应 I,在 0.1 MPa、0.2 MPa、0.3 MPa 和 0.4 MPa 压强下,1 - 丁烯平衡转化率 $ (\alpha) $ 随温度的变化如图所示。

① $ p_{1} = $
0.1
MPa,判断的依据是 反应Ⅰ气体分子数增大,温度一定时,减小压强,平衡正向移动,$\alpha$增大(合理即可,2分)
。② $ T_{3}\ {K} $、$ p_{3} $ 压强下,反应 I 的平衡常数 $ K_{p} = $
$\frac{0.4}{1.4}×\frac{0.3}{1.4}×\frac{0.4}{1.4}×\frac{0.3}{1.4}$
MPa(列出计算式,$ K_{p} $ 是用分压代替浓度计算的平衡常数,分压 = 总压×物质的量分数)。(3)1,3 - 丁二烯也可通过 $ {CO_{2}} $ 氧化 1 - 丁烯脱氢制备(方法二),反应分两步,分别为反应 I 和反应 V [反应 V:$ {CO_{2}(g) + H_{2}(g)⇌ CO(g) + H_{2}O(g)} $ $ \Delta H_{5} = +41\ {kJ· mol^{-1}} $ ]。其他条件相同时,方法二中 1 - 丁烯平衡转化率远大于方法一,利用勒夏特列原理解释,引入 $ {CO_{2}} $ 可增大 1 - 丁烯平衡转化率的原因:
反应Ⅰ产生的$\mathrm{H_2}$被$\mathrm{CO_2}$通过反应Ⅴ消耗,使反应Ⅰ平衡正向移动,1 - 丁烯的平衡转化率增大
。(4)方法二制备 1,3 - 丁二烯往往伴随副反应,如反应 II 和 III。一定温度和压强下,为了提高反应速率和 1,3 - 丁二烯选择性,应当
选择合适的催化剂
。
答案:
15.(14分)
(1)①+103.5(2分) 不能(2分)
②〜<〜<〜(2分)
(2)①0.1(1分) 反应Ⅰ气体分子数增大,温度一定时,减小压强,平衡正向移动,$\alpha$增大(合理即可,2分)
②$\frac{0.4}{1.4}×\frac{0.3}{1.4}×\frac{0.4}{1.4}×\frac{0.3}{1.4}$(2分)
(3)反应Ⅰ产生的$\mathrm{H_2}$被$\mathrm{CO_2}$通过反应Ⅴ消耗,使反应Ⅰ平衡正向移动,1 - 丁烯的平衡转化率增大(2分)
(4)选择合适的催化剂(1分)
【解析】化学反应原理
(1)①根据盖斯定律可知,反应Ⅰ=反应Ⅱ+反应Ⅳ,故$\Delta H=\Delta H_2+\Delta H_4=-9.5\mathrm{kJ· mol^{-1}}+(+113\mathrm{kJ· mol^{-1}})=+103.5\mathrm{kJ· mol^{-1}}$;298K时,反应Ⅰ的$\Delta G=\Delta H-T\Delta S=(+103.5\mathrm{kJ· mol^{-1}})-(298K×104×10^{-3}\mathrm{kJ· K^{-1}· mol^{-1}})=+72.508\mathrm{kJ· mol^{-1}}>0$,由$\Delta G<0$时反应可自发进行可知,反应Ⅰ在25℃(298K)时不能自发进行。②由反应Ⅱ、Ⅲ为放热反应,结合能量越低越稳定可知,稳定性:〜<〜<〜。
(2)
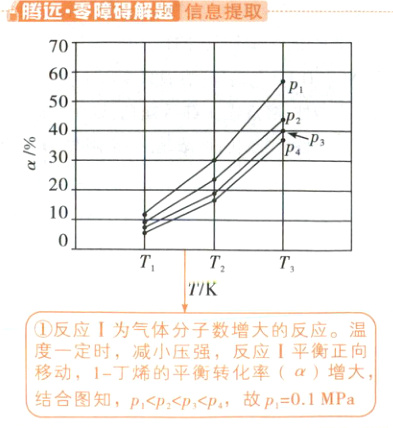
①反应Ⅰ为气体分子数增大的反应。温度一定时,减小压强,反应Ⅰ平衡正向移动,1 - 丁烯的平衡转化率($\alpha$)增大,结合图知,$p_1<p_2<p_3<p_4$,故$p_1=0.1\mathrm{MPa}$
②由信息提取可知,$p_3=0.3\mathrm{MPa}$,$T_3$K、0.3MPa时,1 - 丁烯的平衡转化率为40%,设起始充入的n(1 - 丁烯)=1mol,可列三段式:
〜〜(g) ⇌ 〜〜(g) + $\mathrm{H_2}$(g)
始(mol) 1 0 0
转(mol) 0.4 0.4 0.4
平(mol) 0.6 0.4 0.4
平衡时体系中气体总物质的量为(0.6 + 0.4 + 0.4)mol = 1.4mol,由相同条件下,气体物质的量之比等于压强之比可知,平衡时$p$(〜〜) = $p(\mathrm{H_2})=\frac{0.4}{1.4}×0.3\mathrm{MPa}$,$p$(〜〜) = $\frac{0.6}{1.4}×0.3\mathrm{MPa}$,则反应Ⅰ的平衡常数$K_\mathrm{p}=\frac{p(〜〜)· p(\mathrm{H_2})}{p(〜〜)}=\frac{\frac{0.4}{1.4}×0.3\mathrm{MPa}×\frac{0.4}{1.4}×0.3\mathrm{MPa}}{\frac{0.6}{1.4}×0.3\mathrm{MPa}}$。
(3)由方法二制备1,3 - 丁二烯的两步反应可知,$\mathrm{CO_2}$可以消耗反应Ⅰ产生的$\mathrm{H_2}$,使反应Ⅰ的生成物$\mathrm{H_2}$浓度减小,促使反应Ⅰ平衡正向移动,从而增大1 - 丁烯的平衡转化率。
(4)工业上通常通过选择合适的催化剂加快化学反应速率,同时还可以提高目标产品的选择性,减少副反应的发生。因此,一定温度和压强下,为了提高反应速率和1,3 - 丁二烯的选择性,应当选择合适的催化剂。
15.(14分)
(1)①+103.5(2分) 不能(2分)
②〜<〜<〜(2分)
(2)①0.1(1分) 反应Ⅰ气体分子数增大,温度一定时,减小压强,平衡正向移动,$\alpha$增大(合理即可,2分)
②$\frac{0.4}{1.4}×\frac{0.3}{1.4}×\frac{0.4}{1.4}×\frac{0.3}{1.4}$(2分)
(3)反应Ⅰ产生的$\mathrm{H_2}$被$\mathrm{CO_2}$通过反应Ⅴ消耗,使反应Ⅰ平衡正向移动,1 - 丁烯的平衡转化率增大(2分)
(4)选择合适的催化剂(1分)
【解析】化学反应原理
(1)①根据盖斯定律可知,反应Ⅰ=反应Ⅱ+反应Ⅳ,故$\Delta H=\Delta H_2+\Delta H_4=-9.5\mathrm{kJ· mol^{-1}}+(+113\mathrm{kJ· mol^{-1}})=+103.5\mathrm{kJ· mol^{-1}}$;298K时,反应Ⅰ的$\Delta G=\Delta H-T\Delta S=(+103.5\mathrm{kJ· mol^{-1}})-(298K×104×10^{-3}\mathrm{kJ· K^{-1}· mol^{-1}})=+72.508\mathrm{kJ· mol^{-1}}>0$,由$\Delta G<0$时反应可自发进行可知,反应Ⅰ在25℃(298K)时不能自发进行。②由反应Ⅱ、Ⅲ为放热反应,结合能量越低越稳定可知,稳定性:〜<〜<〜。
(2)

①反应Ⅰ为气体分子数增大的反应。温度一定时,减小压强,反应Ⅰ平衡正向移动,1 - 丁烯的平衡转化率($\alpha$)增大,结合图知,$p_1<p_2<p_3<p_4$,故$p_1=0.1\mathrm{MPa}$
②由信息提取可知,$p_3=0.3\mathrm{MPa}$,$T_3$K、0.3MPa时,1 - 丁烯的平衡转化率为40%,设起始充入的n(1 - 丁烯)=1mol,可列三段式:
〜〜(g) ⇌ 〜〜(g) + $\mathrm{H_2}$(g)
始(mol) 1 0 0
转(mol) 0.4 0.4 0.4
平(mol) 0.6 0.4 0.4
平衡时体系中气体总物质的量为(0.6 + 0.4 + 0.4)mol = 1.4mol,由相同条件下,气体物质的量之比等于压强之比可知,平衡时$p$(〜〜) = $p(\mathrm{H_2})=\frac{0.4}{1.4}×0.3\mathrm{MPa}$,$p$(〜〜) = $\frac{0.6}{1.4}×0.3\mathrm{MPa}$,则反应Ⅰ的平衡常数$K_\mathrm{p}=\frac{p(〜〜)· p(\mathrm{H_2})}{p(〜〜)}=\frac{\frac{0.4}{1.4}×0.3\mathrm{MPa}×\frac{0.4}{1.4}×0.3\mathrm{MPa}}{\frac{0.6}{1.4}×0.3\mathrm{MPa}}$。
(3)由方法二制备1,3 - 丁二烯的两步反应可知,$\mathrm{CO_2}$可以消耗反应Ⅰ产生的$\mathrm{H_2}$,使反应Ⅰ的生成物$\mathrm{H_2}$浓度减小,促使反应Ⅰ平衡正向移动,从而增大1 - 丁烯的平衡转化率。
(4)工业上通常通过选择合适的催化剂加快化学反应速率,同时还可以提高目标产品的选择性,减少副反应的发生。因此,一定温度和压强下,为了提高反应速率和1,3 - 丁二烯的选择性,应当选择合适的催化剂。
查看更多完整答案,请扫码查看


