2026年高考基础卷高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考基础卷高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第12页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
11. 下列陈述Ⅰ与陈述Ⅱ均正确,且两者具有因果关系的是(

D
)
答案:
11.D 元素及其化合物 【解析】甲苯能使酸性$KMnO_4$溶液褪色,是甲苯分子中的苯环影响了甲基,使甲基易被氧化,甲苯分子中不含碳碳双键,A错误;氢氟酸(HF的水溶液)能与玻璃的主要成分$SiO_2$发生反应:$4HF + SiO_2 = SiF_4↑ + 2H_2O$,故氢氟酸不能用玻璃试剂瓶盛放,与$SiO_2$是酸性氧化物无关,B错误;用熟石灰处理酸性废水,是因为熟石灰中的$OH^-$可以中和酸性废水中的$H^+$,与$Ca^{2+}$无关,C错误;丙三醇($CH_2OHCHOHCH_2OH$)分子中含有羟基,能与水形成分子间氢键,从而具有强吸水能力,故可用丙三醇制造化妆品,两者具有因果关系,D正确。
12. 下列有关物质结构与性质的说法正确的是(
A.分子的极性:BF₃ > NF₃
B.微粒中 N—O 的键长:NO₂⁻ > NO₃⁻
C.H—N—H 的键角:NH₃ < [Cu(NH₃)₄]²⁺
D.化学键中离子键成分的百分数:Na₂S > Na₂O
C
)A.分子的极性:BF₃ > NF₃
B.微粒中 N—O 的键长:NO₂⁻ > NO₃⁻
C.H—N—H 的键角:NH₃ < [Cu(NH₃)₄]²⁺
D.化学键中离子键成分的百分数:Na₂S > Na₂O
答案:
12.C 物质结构与性质 【解析】$BF_3$中心原子B的孤电子对数为$\frac{3 - 1×3}{2} = 0$,$\sigma$键电子对数为3,空间结构为平面三角形,$BF_3$为非极性分子,$NF_3$中心原子N的孤电子对数为$\frac{5 - 1×3}{2} = 1$,$\sigma$键电子对数为3,空间结构为三角锥形,$NF_3$为极性分子,故分子的极性:$BF_3 < NF_3$,A错误;$NO_2^-$和$NO_3^-$中心原子N的价层电子对数均为3,但$NO_3^-$中N和O的成键比$NO_2^-$多,化学键间的斥力更大,键长更长,故微粒中N—O的键长:$NO_2^- < NO_3^-$,B错误;$NH_3$、$[Cu(NH_3)_4]^{2+}$中的N原子均采取$sp^3$杂化,$NH_3$中心原子N的孤电子对数为1,$[Cu(NH_3)_4]^{2+}$中N与Cu之间形成配位键,使N不含孤电子对,孤电子对与成键电子对之间的排斥力比成键电子对之间的排斥力大,故H—N—H的键角:$NH_3 < [Cu(NH_3)_4]^{2+}$,C正确;元素电负性差值越大,离子键的百分数越大,电负性:O>S>Na,故化学键中离子键成分的百分数:$Na_2S < Na_2O$,D错误。
13. W、X、Y、Z 为原子序数依次增大的前四周期主族元素,X 与 Y 同周期,W 与 Y 同主族,且原子序数满足关系:2W = Y + 1,基态 X 原子核外 s 能级电子数与 p 能级电子数相等,Z 的原子半径是前四周期主族元素中最大的。下列说法正确的是(
A.第一电离能:Z > X
B.晶体熔点:ZW > ZY
C.简单氢化物的沸点:W < Y
D.工业上通过电解熔融 X 的氧化物制备 X 单质
B
)A.第一电离能:Z > X
B.晶体熔点:ZW > ZY
C.简单氢化物的沸点:W < Y
D.工业上通过电解熔融 X 的氧化物制备 X 单质
答案:
13.B 物质结构与元素周期律
腾远·零障碍解题 元素推断
由“Z的原子半径是前四周期主族元素中最大的”结合同周期主族元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大可知,Z为钾元素;由原子序数:X<Z(K)及“基态X原子核外s能级电子数与p能级电子数相等”可知,基态X原子核外电子排布式为$1s^22s^22p^4$或$1s^22s^22p^63s^2$,X为氧元素或镁元素,若X为氧元素,结合“X与Y同周期”且原子序数:X<Y可知,Y为氟元素,没有符合“W与Y同主族”的W元素,故X为镁元素,则Y位于第三周期,W位于第二周期,由W与Y的原子序数满足关系:2W=Y+1,结合第二周期与第三周期同主族元素原子序数相差8可列式,2W=W+8+1,解得W=9,故W为氟元素、Y为氯元素。
【解析】同周期从左到右,元素的第一电离能整体呈增大趋势,同主族从上到下,元素的第一电离能逐渐减小,故第一电离能:$Mg(>Na)>K$,A错误;$KF$和$KCl$均为离子晶体,影响离子晶体熔点的主要因素是离子半径和离子所带电荷数,离子半径越小、所带电荷数越多,离子键越强,离子晶体熔点越高,离子半径:$F^- < Cl^-$,则晶体熔点:$KF > KCl$,B正确;$HF$分子间存在氢键使其沸点升高,故沸点:$HF > HCl$,C错误;工业上通过电解熔融$MgCl_2$制备$Mg$单质,D错误。
腾远·零障碍解题 元素推断
由“Z的原子半径是前四周期主族元素中最大的”结合同周期主族元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大可知,Z为钾元素;由原子序数:X<Z(K)及“基态X原子核外s能级电子数与p能级电子数相等”可知,基态X原子核外电子排布式为$1s^22s^22p^4$或$1s^22s^22p^63s^2$,X为氧元素或镁元素,若X为氧元素,结合“X与Y同周期”且原子序数:X<Y可知,Y为氟元素,没有符合“W与Y同主族”的W元素,故X为镁元素,则Y位于第三周期,W位于第二周期,由W与Y的原子序数满足关系:2W=Y+1,结合第二周期与第三周期同主族元素原子序数相差8可列式,2W=W+8+1,解得W=9,故W为氟元素、Y为氯元素。
【解析】同周期从左到右,元素的第一电离能整体呈增大趋势,同主族从上到下,元素的第一电离能逐渐减小,故第一电离能:$Mg(>Na)>K$,A错误;$KF$和$KCl$均为离子晶体,影响离子晶体熔点的主要因素是离子半径和离子所带电荷数,离子半径越小、所带电荷数越多,离子键越强,离子晶体熔点越高,离子半径:$F^- < Cl^-$,则晶体熔点:$KF > KCl$,B正确;$HF$分子间存在氢键使其沸点升高,故沸点:$HF > HCl$,C错误;工业上通过电解熔融$MgCl_2$制备$Mg$单质,D错误。
14. 跨学科 生物菌群 微生物电解池(MEC)具有绿色、环保、效率高等优势,可用于 CO₂的捕集。某科研小组以 NaHCO₃为碳源,设计出双室型 MEC,原理如图所示,下列说法正确的是(
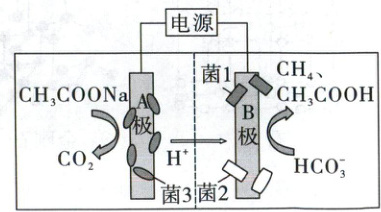
已知:在不同菌群的作用下,HCO₃⁻转化的产物不同。
A.A 极连接电源负极
B.电子的流动方向:A 极→电解液→B 极
C.改变 B 极的菌群可实现产物的定向调控
D.电路中有 8 mol 电子流过时,B 极产生 60 g CH₃COOH
C
)
已知:在不同菌群的作用下,HCO₃⁻转化的产物不同。
A.A 极连接电源负极
B.电子的流动方向:A 极→电解液→B 极
C.改变 B 极的菌群可实现产物的定向调控
D.电路中有 8 mol 电子流过时,B 极产生 60 g CH₃COOH
答案:
14.C 电解池
腾远·零障碍解题 电池分析
装置判断:由装置连接电源可知,该装置为电解池。
电极判断:A极,$CH_3COO^-$转化为$CO_2$,发生失电子的氧化反应,作阳极。
B极,$HCO_3^-$转化为$CH_3COOH$、$CH_4$,发生得电子的还原反应,作阴极。
电极 电极区反应
阳极区 A极 $CH_3COO^- - 8e^- + 2H_2O = 2CO_2↑ + 7H^+$
阴极区 B极 $HCO_3^- + 8e^- + 9H^+ = CH_4↑ + 3H_2O$、$2HCO_3^- + 8e^- + 10H^+ = CH_3COOH + 4H_2O$
总反应 $CH_3COO^- + HCO_3^- + 2H^+ \stackrel{电解}{=} 2CO_2↑ + CH_4↑ + H_2O$、$CH_3COO^- + 2HCO_3^- + 3H^+ \stackrel{电解}{=} 2CO_2↑ + CH_3COOH + 2H_2O$
高考基础卷·化学 【解析】由电池分析可知,A极为阳极,与电源正极相连,A错误;电子不在电解液中流动,B错误;由已知信息知,在不同菌群调控下,$HCO_3^-$转化产物不同,即改变B极的菌群结构可实现产物的定向调控,C正确;由阴极电极反应式可知,电路中流过8mol电子时,B极同时产生$CH_4$和$CH_3COOH$,即产生$CH_3COOH$的物质的量小于1mol,质量小于60g,D错误。
腾远·零障碍解题 电池分析
装置判断:由装置连接电源可知,该装置为电解池。
电极判断:A极,$CH_3COO^-$转化为$CO_2$,发生失电子的氧化反应,作阳极。
B极,$HCO_3^-$转化为$CH_3COOH$、$CH_4$,发生得电子的还原反应,作阴极。
电极 电极区反应
阳极区 A极 $CH_3COO^- - 8e^- + 2H_2O = 2CO_2↑ + 7H^+$
阴极区 B极 $HCO_3^- + 8e^- + 9H^+ = CH_4↑ + 3H_2O$、$2HCO_3^- + 8e^- + 10H^+ = CH_3COOH + 4H_2O$
总反应 $CH_3COO^- + HCO_3^- + 2H^+ \stackrel{电解}{=} 2CO_2↑ + CH_4↑ + H_2O$、$CH_3COO^- + 2HCO_3^- + 3H^+ \stackrel{电解}{=} 2CO_2↑ + CH_3COOH + 2H_2O$
高考基础卷·化学 【解析】由电池分析可知,A极为阳极,与电源正极相连,A错误;电子不在电解液中流动,B错误;由已知信息知,在不同菌群调控下,$HCO_3^-$转化产物不同,即改变B极的菌群结构可实现产物的定向调控,C正确;由阴极电极反应式可知,电路中流过8mol电子时,B极同时产生$CH_4$和$CH_3COOH$,即产生$CH_3COOH$的物质的量小于1mol,质量小于60g,D错误。
查看更多完整答案,请扫码查看


