2026年高考基础卷高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考基础卷高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第25页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
16.(14分)甲醇不仅是重要的化工原料,还是性能优良的能源。二氧
化碳催化加氢制甲醇可以减少温室气体排放、利用废弃物产生有
用的化学品、促进甲醇的广泛应用和推动能源转型,这些优点使
得二氧化碳加氢制甲醇技术成为当前最受关注的环保技术之一。
已知几种相关物质的相对能量(E)如表所示。
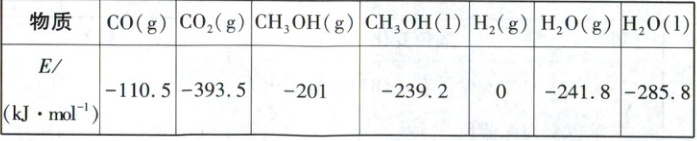
CO2催化加氢制甲醇的总反应为CO2(g)+3H2(g)− CH3OH(g)+
H2O(g)△H,该反应一般可以通过如下步骤来实现:
Ⅰ.CO2(g)+H(g)1CO(g)+H,O(g) △H,1
Ⅱ.CO(g)+2H(g)CHOH(g) AH
回答下列问题:
(1)角度新结合图像绘制考查盖斯定律|经两步反应生成甲醇的
反应历程一相对能量变化图如图1所示,反应I为决速步骤,补全
图中缺失的曲线和纵坐标数据。
(2)某温度下,向容积为2L的恒温恒容密闭容器中充入1mol
CO2和2molH2,发生反应I、II,5min时达到平衡,CO2的平衡
转化率为50%,CHOH 的选择性S为 80%(S=
转化为目标已产转物化C的HOCHO2消的耗量的CO2的量×100%)。
①若初始压强为4.5MPa,则0~5min内,以CHOH分压表示的
反应速率为
(保留3位有效数字)。
②二氧化碳加氢合成甲醇往往伴有副反应,生成CH4、C2H4等物
质。一定温度和压强下,为提高反应速率和甲醇的选择性,可采
取的措施有
(3)T℃时,将0.40molCO2与0.10molH充入5L的刚性密闭
容器中,若只发生反应I,达到平衡时,H20的物质的量分数
x(H20)=0.08。
①CO2的平衡转化率α=
②由T℃时,上述实验数据计算得到v−x(H2)、v−x(CO)的关
系如图2所示。降低温度,反应重新达到平衡时−x(H2)、逆一
x(CO)相应的点分别可能变为

化碳催化加氢制甲醇可以减少温室气体排放、利用废弃物产生有
用的化学品、促进甲醇的广泛应用和推动能源转型,这些优点使
得二氧化碳加氢制甲醇技术成为当前最受关注的环保技术之一。
已知几种相关物质的相对能量(E)如表所示。

CO2催化加氢制甲醇的总反应为CO2(g)+3H2(g)− CH3OH(g)+
H2O(g)△H,该反应一般可以通过如下步骤来实现:
Ⅰ.CO2(g)+H(g)1CO(g)+H,O(g) △H,1
Ⅱ.CO(g)+2H(g)CHOH(g) AH
回答下列问题:
(1)角度新结合图像绘制考查盖斯定律|经两步反应生成甲醇的
反应历程一相对能量变化图如图1所示,反应I为决速步骤,补全
图中缺失的曲线和纵坐标数据。
(2)某温度下,向容积为2L的恒温恒容密闭容器中充入1mol
CO2和2molH2,发生反应I、II,5min时达到平衡,CO2的平衡
转化率为50%,CHOH 的选择性S为 80%(S=
转化为目标已产转物化C的HOCHO2消的耗量的CO2的量×100%)。
①若初始压强为4.5MPa,则0~5min内,以CHOH分压表示的
反应速率为
0.12(2分)
MPa.min1;反应II[的Kp=3.63(2分)
MPa−2(保留3位有效数字)。
②二氧化碳加氢合成甲醇往往伴有副反应,生成CH4、C2H4等物
质。一定温度和压强下,为提高反应速率和甲醇的选择性,可采
取的措施有
加入合适的催化剂(2分)
。(3)T℃时,将0.40molCO2与0.10molH充入5L的刚性密闭
容器中,若只发生反应I,达到平衡时,H20的物质的量分数
x(H20)=0.08。
①CO2的平衡转化率α=
10(2分)
%。②由T℃时,上述实验数据计算得到v−x(H2)、v−x(CO)的关
系如图2所示。降低温度,反应重新达到平衡时−x(H2)、逆一
x(CO)相应的点分别可能变为
G(1分)
)A(1分)
(填字母)。

答案:
16.(14分)
(1)
 (4分,绘制曲线2分,补全数据2分)
(4分,绘制曲线2分,补全数据2分)
(2)①0.12(2分) 3.63(2分) ②加入合适的催化剂(2分)
(3)①10(2分) ②G(1分) A(1分)
【解析】化学反应原理
(1)根据题表中各物质的相对能量计算出反应物、生成物所具有的总能量,反应Ⅰ中反应物的能量为-393.5kJ,生成物的能量为(-110.5kJ)+(-241.8kJ)=-352.3kJ;最终产物为1molCH₃OH(g)、1molH₂O(g),其能量为(-201kJ)+(-241.8kJ)=-442.8kJ。又因为反应Ⅰ为决速步骤,所以反应Ⅰ的活化能比反应Ⅱ的活化能大,综上可绘制出CO₂催化加氢制甲醇的反应过程中能量变化示意图。
(2)①CO₂的平衡转化率为50%,CH₃OH的选择性为80%,故反应中消耗CO₂的物质的量为1mol×50%=0.5mol,体系中剩余CO₂的物质的量为0.5mol,生成CH₃OH的物质的量为0.5mol×80%=0.4mol。
三段式法:
假设反应Ⅰ达到平衡后再发生反应Ⅱ,列三段式:
反应Ⅰ
CO₂(g)+H₂(g)⇌CO(g)+H₂O(g)
始(mol) 1 2 0 0
转(mol) 0.5 0.5 0.5 0.5
平(mol) 0.5 1.5 0.5 0.5
反应Ⅱ
CO(g)+2H₂(g)⇌CH₃OH(g)
始(mol) 0.5 1.5 0
转(mol) 0.4 0.8 0.4
平(mol) 0.1 0.7 0.4
原子守恒法:
由C原子守恒可得:nₚ(CO₂)+nₚ(CO)+nₚ(CH₃OH)=1mol
由H原子守恒可得:2nₚ(H₂)+2nₚ(H₂O)+4nₚ(CH₃OH)=2×2mol=4mol
由O原子守恒可得:2nₚ(CO₂)+nₚ(CO)+nₚ(CH₃OH)+nₚ(H₂O)=2mol
结合nₚ(CO₂)=0.5mol、nₚ(CH₃OH)=0.4mol可得,nₚ(CO)=0.1mol、nₚ(H₂O)=0.5mol、nₚ(H₂)=0.7mol。
在恒温恒容的密闭容器中,气体的压强之比等于其物质的量之比,平衡时气体的总物质的量为(0.1+0.7+0.4+0.5+0.5)mol=2.2mol,设反应后气体的压强为xMPa,则2.2mol/3mol=xMPa/4.5MPa,故x=3.3,则平衡时,p(CO₂)=0.5mol/2.2mol×3.3MPa=0.75MPa,p(H₂)=1.05MPa、p(H₂O)=0.75MPa、p(CO)=0.15MPa、p(CH₃OH)=0.60MPa。CH₃OH的初始分压为0MPa,则0~5min内,以CH₃OH分压表示的反应速率为(0.60MPa - 0MPa)/5min=0.12MPa·min⁻¹;反应Ⅱ的压强平衡常数K_p=p(CH₃OH)/[p(CO)·p²(H₂)]=0.60MPa/(0.15MPa×1.05²MPa²)≈3.63MPa⁻²;②为了提高反应速率和甲醇的选择性,可以向体系中加入合适的催化剂。
(3)①设T℃平衡时CO₂的转化量为ymol,列三段式:
CO₂(g)+H₂(g)⇌CO(g)+H₂O(g)
始(mol) 0.40 0.10 0 0
转(mol) y y y y
平(mol) 0.40-y 0.10-y y y
该反应左右两边气体的化学计量数之和相等,反应达到平衡时,气体的总物质的量不变,nₑ=0.50mol,则x(H₂O)=y/0.50mol=0.08,y=0.04,n(CO₂)=0.36mol,n(H₂)=0.06mol,n(CO)=n(H₂O)=0.04mol,CO₂的平衡转化率α=0.04mol/0.40mol×100%=10%。
答案详解详析
腾远·零障碍解题 信息提取
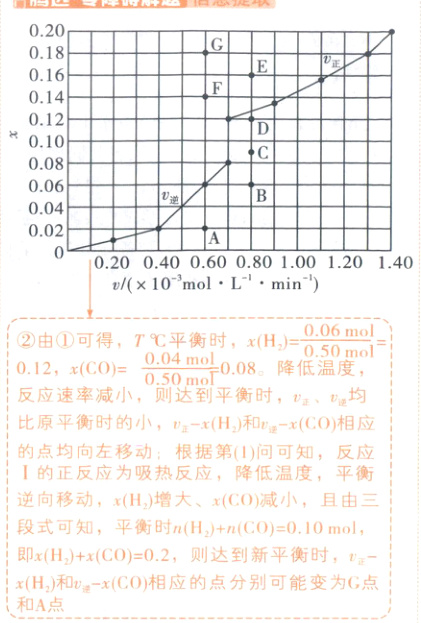
②由①可得,T℃平衡时,x(H₂)=0.06mol/0.50mol=0.12,x(CO)=0.04mol/0.50mol=0.08。降低温度,反应速率减小,则达到平衡时,vₑ、vₑ均比原平衡时的小,vₑ=x(H₂)和vₑ=x(CO)相应的点均向左移动;根据第
(1)问可知,反应Ⅰ的正反应为吸热反应,降低温度,平衡逆向移动,x(H₂)增大、x(CO)减小,且由三段式可知,平衡时n(H₂)+n(CO)=0.10mol,即x(H₂)+x(CO)=0.2,则达到新平衡时,vₑ=x(H₂)和vₑ=x(CO)相应的点分别可能变为G点和A点。
16.(14分)
(1)
 (4分,绘制曲线2分,补全数据2分)
(4分,绘制曲线2分,补全数据2分)(2)①0.12(2分) 3.63(2分) ②加入合适的催化剂(2分)
(3)①10(2分) ②G(1分) A(1分)
【解析】化学反应原理
(1)根据题表中各物质的相对能量计算出反应物、生成物所具有的总能量,反应Ⅰ中反应物的能量为-393.5kJ,生成物的能量为(-110.5kJ)+(-241.8kJ)=-352.3kJ;最终产物为1molCH₃OH(g)、1molH₂O(g),其能量为(-201kJ)+(-241.8kJ)=-442.8kJ。又因为反应Ⅰ为决速步骤,所以反应Ⅰ的活化能比反应Ⅱ的活化能大,综上可绘制出CO₂催化加氢制甲醇的反应过程中能量变化示意图。
(2)①CO₂的平衡转化率为50%,CH₃OH的选择性为80%,故反应中消耗CO₂的物质的量为1mol×50%=0.5mol,体系中剩余CO₂的物质的量为0.5mol,生成CH₃OH的物质的量为0.5mol×80%=0.4mol。
三段式法:
假设反应Ⅰ达到平衡后再发生反应Ⅱ,列三段式:
反应Ⅰ
CO₂(g)+H₂(g)⇌CO(g)+H₂O(g)
始(mol) 1 2 0 0
转(mol) 0.5 0.5 0.5 0.5
平(mol) 0.5 1.5 0.5 0.5
反应Ⅱ
CO(g)+2H₂(g)⇌CH₃OH(g)
始(mol) 0.5 1.5 0
转(mol) 0.4 0.8 0.4
平(mol) 0.1 0.7 0.4
原子守恒法:
由C原子守恒可得:nₚ(CO₂)+nₚ(CO)+nₚ(CH₃OH)=1mol
由H原子守恒可得:2nₚ(H₂)+2nₚ(H₂O)+4nₚ(CH₃OH)=2×2mol=4mol
由O原子守恒可得:2nₚ(CO₂)+nₚ(CO)+nₚ(CH₃OH)+nₚ(H₂O)=2mol
结合nₚ(CO₂)=0.5mol、nₚ(CH₃OH)=0.4mol可得,nₚ(CO)=0.1mol、nₚ(H₂O)=0.5mol、nₚ(H₂)=0.7mol。
在恒温恒容的密闭容器中,气体的压强之比等于其物质的量之比,平衡时气体的总物质的量为(0.1+0.7+0.4+0.5+0.5)mol=2.2mol,设反应后气体的压强为xMPa,则2.2mol/3mol=xMPa/4.5MPa,故x=3.3,则平衡时,p(CO₂)=0.5mol/2.2mol×3.3MPa=0.75MPa,p(H₂)=1.05MPa、p(H₂O)=0.75MPa、p(CO)=0.15MPa、p(CH₃OH)=0.60MPa。CH₃OH的初始分压为0MPa,则0~5min内,以CH₃OH分压表示的反应速率为(0.60MPa - 0MPa)/5min=0.12MPa·min⁻¹;反应Ⅱ的压强平衡常数K_p=p(CH₃OH)/[p(CO)·p²(H₂)]=0.60MPa/(0.15MPa×1.05²MPa²)≈3.63MPa⁻²;②为了提高反应速率和甲醇的选择性,可以向体系中加入合适的催化剂。
(3)①设T℃平衡时CO₂的转化量为ymol,列三段式:
CO₂(g)+H₂(g)⇌CO(g)+H₂O(g)
始(mol) 0.40 0.10 0 0
转(mol) y y y y
平(mol) 0.40-y 0.10-y y y
该反应左右两边气体的化学计量数之和相等,反应达到平衡时,气体的总物质的量不变,nₑ=0.50mol,则x(H₂O)=y/0.50mol=0.08,y=0.04,n(CO₂)=0.36mol,n(H₂)=0.06mol,n(CO)=n(H₂O)=0.04mol,CO₂的平衡转化率α=0.04mol/0.40mol×100%=10%。
答案详解详析
腾远·零障碍解题 信息提取

②由①可得,T℃平衡时,x(H₂)=0.06mol/0.50mol=0.12,x(CO)=0.04mol/0.50mol=0.08。降低温度,反应速率减小,则达到平衡时,vₑ、vₑ均比原平衡时的小,vₑ=x(H₂)和vₑ=x(CO)相应的点均向左移动;根据第
(1)问可知,反应Ⅰ的正反应为吸热反应,降低温度,平衡逆向移动,x(H₂)增大、x(CO)减小,且由三段式可知,平衡时n(H₂)+n(CO)=0.10mol,即x(H₂)+x(CO)=0.2,则达到新平衡时,vₑ=x(H₂)和vₑ=x(CO)相应的点分别可能变为G点和A点。
查看更多完整答案,请扫码查看


