第59页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1. (2024·玉溪模拟)已知亚硝酸钠(NaNO₂)的外观与食盐很相似,有咸味,误食会使人中毒。亚硝酸钠易分解,放出有刺激性气味的气体,你认为此气体可能是(
A.NH₃
B.N₂
C.SO₂
D.NO₂
D
)A.NH₃
B.N₂
C.SO₂
D.NO₂
答案:
1.D
2. 火箭使用的一种燃料是偏二甲肼(C₂H₈N₂),其燃烧的化学方程式为 C₂H₈N₂ + 2N₂O₄ = 2X + 3N₂ + 4H₂O。下列说法错误的是(
A.常温常压下 X 为一种无色无毒的气体
B.一个 C₂H₈N₂ 分子由 12 个原子构成
C.C₂H₈N₂ 中氮元素的质量分数为 40%
D.反应前后氮元素的化合价发生了变化
C
)A.常温常压下 X 为一种无色无毒的气体
B.一个 C₂H₈N₂ 分子由 12 个原子构成
C.C₂H₈N₂ 中氮元素的质量分数为 40%
D.反应前后氮元素的化合价发生了变化
答案:
2.C
3. 【化学与能源】(2024·重庆)CO₂ 的捕集和利用是我国能源领域的重要战略方向。下图是 CO₂ 的捕集与转化示意图,有关说法正确的是(
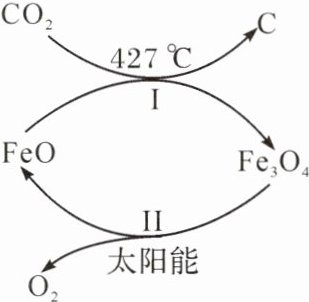
A.FeO 可以循环使用
B.反应Ⅰ属于化合反应
C.反应Ⅱ固体质量增加
D.铁的氧化物之间转化的条件相同
]
A
)
A.FeO 可以循环使用
B.反应Ⅰ属于化合反应
C.反应Ⅱ固体质量增加
D.铁的氧化物之间转化的条件相同
]
答案:
3.A
4. (2024·深圳)小强同学发现 H₂ 和 CO₂ 在同一条件下会发生两个化学反应。一般反应Ⅰ来制取甲醇(CH₃OH),下列说法错误的是(
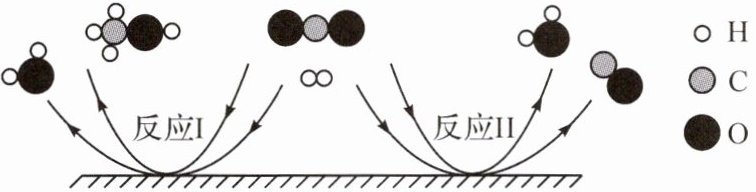
A.在反应Ⅰ中,参加反应的 H₂ 和 CO₂ 的分子个数比为 3:1
B.反应Ⅱ前后的分子数量发生改变
C.小丁同学想要增加甲醇的产量,就要减少反应Ⅱ的发生
D.利用这两个反应不仅可以减少温室气体的排放,还可以产生燃料
]
B
)
A.在反应Ⅰ中,参加反应的 H₂ 和 CO₂ 的分子个数比为 3:1
B.反应Ⅱ前后的分子数量发生改变
C.小丁同学想要增加甲醇的产量,就要减少反应Ⅱ的发生
D.利用这两个反应不仅可以减少温室气体的排放,还可以产生燃料
]
答案:
4.B
5. 【传统文化】(2024·青海)《天工开物》中有我国古代炼铁记载,炼铁的主要原理是 Fe₂O₃ + 3CO $\xlongequal{高温}$ 2Fe + 3X,X 的化学式为(
A.H₂O
B.CO
C.Fe₃O₄
D.CO₂
D
)A.H₂O
B.CO
C.Fe₃O₄
D.CO₂
答案:
5.D
6. 将 20g H₂、O₂、N₂ 的混合气体点燃,完全反应后生成 18g 水,则剩余气体不可能是(
A.N₂ 和 H₂
B.O₂ 和 N₂
C.2g N₂
D.H₂、O₂ 和 N₂
D
)A.N₂ 和 H₂
B.O₂ 和 N₂
C.2g N₂
D.H₂、O₂ 和 N₂
答案:
6.D
7. (2024·龙东)密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法错误的是(
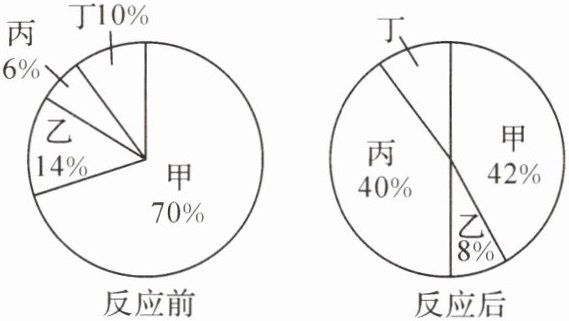
A.该反应基本反应类型为化合反应
B.该化学反应中乙、丙质量比为 3:17
C.物质丙可能为单质
D.物质丁可能是该反应的催化剂
]
C
)
A.该反应基本反应类型为化合反应
B.该化学反应中乙、丙质量比为 3:17
C.物质丙可能为单质
D.物质丁可能是该反应的催化剂
]
答案:
7.C
8. 高温煅烧石灰石可制取氧化钙(CaCO₃ $\xlongequal{高温}$ CaO + CO₂↑)。现有 100kg 碳酸钙,高温煅烧一段时间后,剩余固体的质量为 67kg。下列推断错误的是(
A.生成 CO₂ 的质量是 33kg
B.生成物中 CaO 的质量是 42kg
C.剩余固体中钙元素的质量分数大于 40%
D.剩余固体中碳元素与氧元素的质量比大于 1:4
D
)A.生成 CO₂ 的质量是 33kg
B.生成物中 CaO 的质量是 42kg
C.剩余固体中钙元素的质量分数大于 40%
D.剩余固体中碳元素与氧元素的质量比大于 1:4
答案:
8.D
9. 【化学与材料】金属镁是一种重要的国防材料,它广泛应用于火箭、导弹和飞机制造业。
(1)发现镁:1792 年,科学家首次发现通过加热苦土(MgO)和木炭的混合物可制得金属镁、同时生成一种能灭火的气体,该反应的化学方程式为:________________________。
(2)炼镁:海水提镁的主要流程如下:
其中“Mg(OH)₂ 中加入盐酸”发生反应的化学方程式为:_______。母液中含有氯化镁,电解氯化镁可制得镁和氯气,请写出该步的化学方程式:_______。
(3)应用镁:①利用金属镁燃烧发出耀眼的白光,可制照明弹,写出镁燃烧的化学方程式:________________________;②金属镁可制取 MgH₂,常温下,MgH₂ 可以与水反应释放出 H₂,同时生成氢氧化镁,写出该反应的化学方程式:________________________。
(1)发现镁:1792 年,科学家首次发现通过加热苦土(MgO)和木炭的混合物可制得金属镁、同时生成一种能灭火的气体,该反应的化学方程式为:________________________。
(2)炼镁:海水提镁的主要流程如下:
其中“Mg(OH)₂ 中加入盐酸”发生反应的化学方程式为:_______。母液中含有氯化镁,电解氯化镁可制得镁和氯气,请写出该步的化学方程式:_______。
(3)应用镁:①利用金属镁燃烧发出耀眼的白光,可制照明弹,写出镁燃烧的化学方程式:________________________;②金属镁可制取 MgH₂,常温下,MgH₂ 可以与水反应释放出 H₂,同时生成氢氧化镁,写出该反应的化学方程式:________________________。
答案:
9.
(1)C+2MgO$\xlongequal{\triangle}$2Mg+CO₂↑
(2)MgCl₂$\xlongequal{通电}$Mg+Cl₂↑
(3)2Mg+O₂$\xlongequal{点燃}$2MgO
MgH₂+2H₂O=Mg(OH)₂+2H₂↑
(1)C+2MgO$\xlongequal{\triangle}$2Mg+CO₂↑
(2)MgCl₂$\xlongequal{通电}$Mg+Cl₂↑
(3)2Mg+O₂$\xlongequal{点燃}$2MgO
MgH₂+2H₂O=Mg(OH)₂+2H₂↑
查看更多完整答案,请扫码查看


