19. (14分)在实验室里需要$80g质量分数为10\%$的氯化钠溶液,溶液配制过程如图所示。
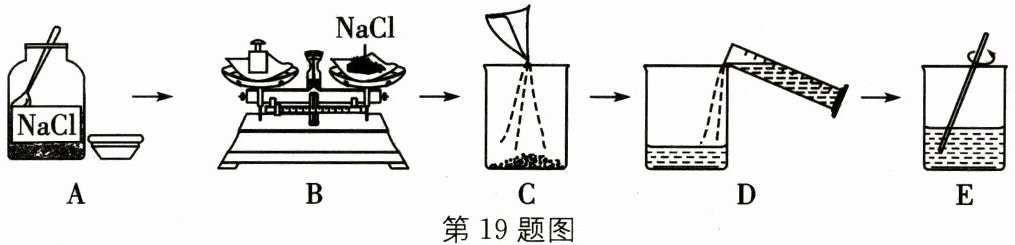
请回答下列问题:(水的密度可近似为$1g/cm^{3}$)
(1)配制$80g质量分数为10\%$的氯化钠溶液,所需氯化钠的质量为
(2)$D$操作应选用
(3)$E$操作中玻璃棒的作用是
(4)配制过程有以下步骤:① 称量及量取;② 计算;③ 装瓶贴标签;④ 溶解。正确的操作顺序是
A. ①②③④
B. ②①③④
C. ②①③④
D. ②①④③
(5)下列因素会造成所配溶液溶质质量分数偏大的是
A. 量取蒸馏水时仰视读数
B. 量取蒸馏水时俯视读数
C. 配好的溶液转移到试剂瓶时,部分溅出
D. 实验过程中不小心把蒸馏水洒落在烧杯外

请回答下列问题:(水的密度可近似为$1g/cm^{3}$)
(1)配制$80g质量分数为10\%$的氯化钠溶液,所需氯化钠的质量为
8
g,水的质量为72
g。(2)$D$操作应选用
100mL
(填“$10mL$”或“$100mL$”)的量筒,量筒必须放平稳,视线要与量筒内凹液面最低处
保持水平。(3)$E$操作中玻璃棒的作用是
搅拌,加速氯化钠溶解
。(4)配制过程有以下步骤:① 称量及量取;② 计算;③ 装瓶贴标签;④ 溶解。正确的操作顺序是
D
(填字母)。A. ①②③④
B. ②①③④
C. ②①③④
D. ②①④③
(5)下列因素会造成所配溶液溶质质量分数偏大的是
BD
(填字母)。A. 量取蒸馏水时仰视读数
B. 量取蒸馏水时俯视读数
C. 配好的溶液转移到试剂瓶时,部分溅出
D. 实验过程中不小心把蒸馏水洒落在烧杯外
答案:
8
72
100mL
凹液面最低处
搅拌,加速氯化钠溶解
D
BD
72
100mL
凹液面最低处
搅拌,加速氯化钠溶解
D
BD
20. (9分)现有溶质质量分数为$20\%的硝酸钾溶液150g$,将该溶液分成三等份。
(1)第一份溶液中加入$10g$硝酸钾固体,固体全部溶解,求此时溶液的溶质质量分数。(精确到$0.1\%$)
(2)若要将第二份溶液溶质质量分数变成$25\%$(未析出晶体),则需要恒温蒸发水多少克?
(3)往第三份溶液中加入$40\%的硝酸钾溶液50g$,求此时溶液的溶质质量分数。
(1)第一份溶液中加入$10g$硝酸钾固体,固体全部溶解,求此时溶液的溶质质量分数。(精确到$0.1\%$)
(2)若要将第二份溶液溶质质量分数变成$25\%$(未析出晶体),则需要恒温蒸发水多少克?
(3)往第三份溶液中加入$40\%的硝酸钾溶液50g$,求此时溶液的溶质质量分数。
答案:
解:将上述溶液平均分成三份,每一份的质量为$50\mathrm {g}。$
(1)这时的溶质质量分数为$\mathrm{\frac {10g+50g×20% }{10g+50 g}\times100%≈33.3 %}$
$(2\mathrm {)}$设需要蒸发水的质量为x。
$\frac {50\mathrm {g}×20% }{50\mathrm {g}-x }=25%,$解得$x=10\mathrm {g}$
(3)此时溶液的溶质质量分数为$\mathrm{\frac {50g×20%+50g×40% }{50g+50g }\times100%=30 %}$
(1)这时的溶质质量分数为$\mathrm{\frac {10g+50g×20% }{10g+50 g}\times100%≈33.3 %}$
$(2\mathrm {)}$设需要蒸发水的质量为x。
$\frac {50\mathrm {g}×20% }{50\mathrm {g}-x }=25%,$解得$x=10\mathrm {g}$
(3)此时溶液的溶质质量分数为$\mathrm{\frac {50g×20%+50g×40% }{50g+50g }\times100%=30 %}$
21. (8分)某工厂利用废硫酸溶液与铁反应制取硫酸亚铁。$49t废硫酸溶液中的硫酸与5.6t$铁恰好完全反应。求:
(1)废硫酸溶液中溶质的质量分数。
(2)理论上生产的硫酸亚铁的质量。
(1)废硫酸溶液中溶质的质量分数。
(2)理论上生产的硫酸亚铁的质量。
答案:
解:设参加反应的硫酸质量为x,生成硫酸亚铁的质量为y。
$\mathrm{Fe+H}_2\mathrm{SO}_4\xlongequal[ ]{ }\mathrm{FeSO}_4+\mathrm{H}_2↑$
56 98 152
5.6t x y
$\mathrm{\frac {56 }{5.6t }=\frac {98 }{x }=\frac {152 }{y },解得x=9.8t,y=15.2t }$
废硫酸溶液中溶质的质量分数为$\mathrm{\frac {9.8 t}{ 49t}\times100%= 20 %}$
答:$(1\mathrm {)}$废硫酸溶液中溶质的质量分数为20%;$(2\mathrm {)}$理论上生产硫酸亚铁$15.2\mathrm {t}。$
$\mathrm{Fe+H}_2\mathrm{SO}_4\xlongequal[ ]{ }\mathrm{FeSO}_4+\mathrm{H}_2↑$
56 98 152
5.6t x y
$\mathrm{\frac {56 }{5.6t }=\frac {98 }{x }=\frac {152 }{y },解得x=9.8t,y=15.2t }$
废硫酸溶液中溶质的质量分数为$\mathrm{\frac {9.8 t}{ 49t}\times100%= 20 %}$
答:$(1\mathrm {)}$废硫酸溶液中溶质的质量分数为20%;$(2\mathrm {)}$理论上生产硫酸亚铁$15.2\mathrm {t}。$
查看更多完整答案,请扫码查看


