第119页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
12.B 将16g硫在给定量的氧气中燃烧,有如下实验数据。回答下列问题。
| |第一次|第二次|第三次|
|硫的质量/g|16|16|16|
|给定氧气的质量/g|8|16|24|
|生成二氧化硫的质量/g|16|32|x|
(1)硫与氧气反应的化学方程式为
(2)分析以上数据说明,在三次实验中第
(3)第
(4)表中x的值为
| |第一次|第二次|第三次|
|硫的质量/g|16|16|16|
|给定氧气的质量/g|8|16|24|
|生成二氧化硫的质量/g|16|32|x|
(1)硫与氧气反应的化学方程式为
S + O₂$\xlongequal{点燃}$SO₂
,反应中$m(硫):m(氧气):m(二氧化硫)= $1:1:2
。(2)分析以上数据说明,在三次实验中第
二
次恰好完全反应。(3)第
一
次实验中硫有剩余,剩余8
g。(4)表中x的值为
32
。
答案:
(1)S + O₂$\xlongequal{点燃}$SO₂ 1:1:2
(2)二
(3)一 8
(4)32
(1)S + O₂$\xlongequal{点燃}$SO₂ 1:1:2
(2)二
(3)一 8
(4)32
13.C 质量守恒定律是自然界的普遍规律,它揭示了化学反应中反应物和生成物之间的质量关系。
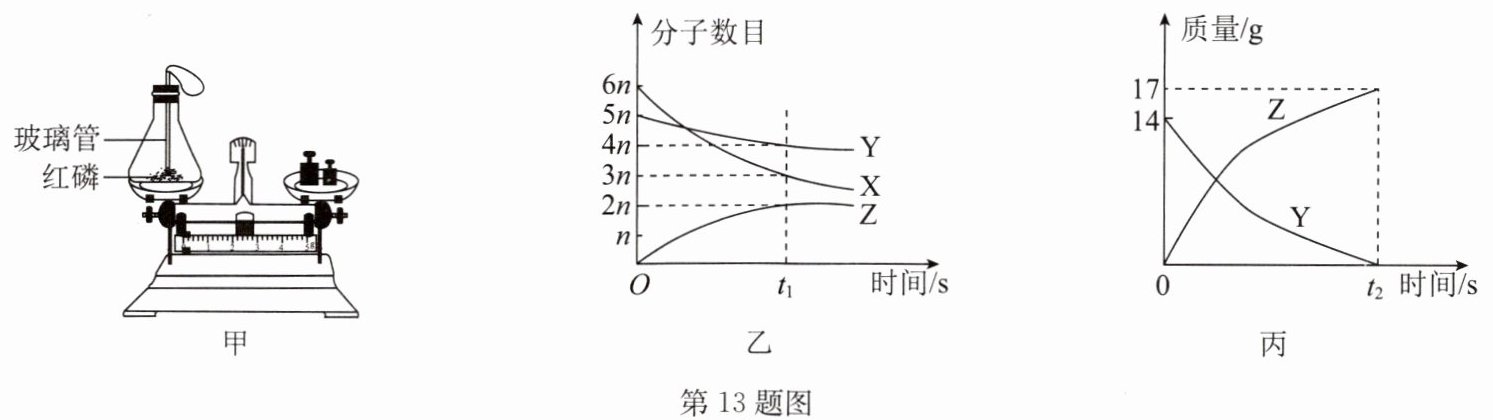
(一)利用如图甲实验验证质量守恒定律,请回答下列问题。
(1)请写出红磷燃烧的符号表达式:
(2)实验时,要先将玻璃管灼烧至红热的目的是
(3)红磷燃烧直至冷却,可观察到玻璃管上的气球
(二)密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图乙所示,物质Y和Z的质量随时间变化情况如图丙所示。请据图回答下列问题。
(4)X与Y在该反应中的质量变化之比为
(5)若Z的相对分子质量为17,则Y的相对分子质量是
(三)请回答有关草酸亚铁的问题。
(6)将0.72g草酸亚铁$(FeC_{2}O_{4})$放在一个可称量的敞口容器中高温焙烧,$500\sim 600^{\circ }C$时,容器中的固体质量保持0.4g不变,该固体是一种氧化物,其化学式为

(一)利用如图甲实验验证质量守恒定律,请回答下列问题。
(1)请写出红磷燃烧的符号表达式:
P + O₂$\xrightarrow{点燃}$P₂O₅
。(2)实验时,要先将玻璃管灼烧至红热的目的是
引燃红磷
。(3)红磷燃烧直至冷却,可观察到玻璃管上的气球
先变大后变小
(填实验现象),天平仍平衡。(二)密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图乙所示,物质Y和Z的质量随时间变化情况如图丙所示。请据图回答下列问题。
(4)X与Y在该反应中的质量变化之比为
3:14
(填最简整数比)。(5)若Z的相对分子质量为17,则Y的相对分子质量是
28
。(三)请回答有关草酸亚铁的问题。
(6)将0.72g草酸亚铁$(FeC_{2}O_{4})$放在一个可称量的敞口容器中高温焙烧,$500\sim 600^{\circ }C$时,容器中的固体质量保持0.4g不变,该固体是一种氧化物,其化学式为
Fe₂O₃
。
答案:
(1)P + O₂$\xrightarrow{点燃}$P₂O₅
(2)引燃红磷
(3)先变大后变小
(4)3:14
(5)28
(6)Fe₂O₃
点拨:
(4)从图丙可以看出, 在t₂时, 参加反应的 Y 的质量为 14g, 生成 Z 的质量为 17g, 根据质量守恒定律, 则参加反应的 X 的质量为17g - 14g = 3g, 参加反应的 X 与 Y 的质量比为3g:14g = 3:14。
(5)从图乙可以看出, 随着反应的进行, Y、X 分子数不断减少, 因此为反应物, Z 分子数不断增加, 则为生成物, 在t₁时 X 参加反应的分子数为6n - 3n = 3n, Y 参加反应的分子数为5n - 4n = n, 生成 Z 的分子数为 2n, 则参加反应的 X、Y、Z 的分子数之比为3n:n:2n = 3:1:2, 根据参加反应的分子数之比等于化学计量数之比, 因此化学方程式为3X + Y = 2Z, 根据图丙可知, 参加反应的 Z、Y 的质量比为17:14, 则2Z:Y = 17:14, 若 Z 的相对分子质量为 17, 则 Y 的相对分子质量为 28。
(6)0.72g 草酸亚铁中含铁元素的质量为0.72g×$\frac{56}{144}$×100% = 0.28g, 反应后固体质量为 0.4g 且该固体是一种氧化物, 则铁元素和氧元素的质量比为0.28g:(0.4g - 0.28g) = 7:3, 设铁的氧化物的化学式为FeₓOᵧ, 56x:16y = 7:3, 则x:y = 2:3, 故所得物质的化学式为Fe₂O₃。
(1)P + O₂$\xrightarrow{点燃}$P₂O₅
(2)引燃红磷
(3)先变大后变小
(4)3:14
(5)28
(6)Fe₂O₃
点拨:
(4)从图丙可以看出, 在t₂时, 参加反应的 Y 的质量为 14g, 生成 Z 的质量为 17g, 根据质量守恒定律, 则参加反应的 X 的质量为17g - 14g = 3g, 参加反应的 X 与 Y 的质量比为3g:14g = 3:14。
(5)从图乙可以看出, 随着反应的进行, Y、X 分子数不断减少, 因此为反应物, Z 分子数不断增加, 则为生成物, 在t₁时 X 参加反应的分子数为6n - 3n = 3n, Y 参加反应的分子数为5n - 4n = n, 生成 Z 的分子数为 2n, 则参加反应的 X、Y、Z 的分子数之比为3n:n:2n = 3:1:2, 根据参加反应的分子数之比等于化学计量数之比, 因此化学方程式为3X + Y = 2Z, 根据图丙可知, 参加反应的 Z、Y 的质量比为17:14, 则2Z:Y = 17:14, 若 Z 的相对分子质量为 17, 则 Y 的相对分子质量为 28。
(6)0.72g 草酸亚铁中含铁元素的质量为0.72g×$\frac{56}{144}$×100% = 0.28g, 反应后固体质量为 0.4g 且该固体是一种氧化物, 则铁元素和氧元素的质量比为0.28g:(0.4g - 0.28g) = 7:3, 设铁的氧化物的化学式为FeₓOᵧ, 56x:16y = 7:3, 则x:y = 2:3, 故所得物质的化学式为Fe₂O₃。
查看更多完整答案,请扫码查看


