7.区分日常生活中的下列各组物质,所加试剂或操作方法完全正确的是
|
选项 |
需区分的物质 |
操作方法或所加试剂 |
|
A. |
白酒与白醋 |
①观察颜色 ②闻气味 |
|
B. |
食盐和白糖 |
①稀盐酸 ②加水溶解 |
|
C. |
合成纤维和天然纤维 |
①烧同时闻气味 ②观察色泽 |
|
D. |
厕所清洁剂与厨房清洁剂 |
①测PH ②石灰石 |
|
A |
物质性质与用途 |
B |
安全常识 |
|
N2性质稳定--填充食品袋防腐 乙醇具有可燃性--可用作燃料 CO具有还原性--可冶炼金属 |
假酒中毒--由甲醇引起 瓦斯爆炸--由甲烷引起 纺织车间爆炸--由可燃性气体引起 |
||
|
C |
元素与人体健康 |
D |
日常生活经验 |
|
缺铁--易引起贫血 缺钙--易得佝偻病或骨质疏松 缺碘--易得甲状腺肿大 |
去衣服上的油污--用汽油洗涤 区别醋与白酒--常用闻气味 使煤燃烧更旺--把煤做成蜂窝状 |
6.小红同学在家做“粗盐提纯”实验,对其做法的认识中,错误的是
A.将粗盐放入玻璃杯中加水溶解--粒子在不断运动
B.溶解时用筷子搅拌--加快溶解速度
C.用自制净水器过滤粗盐水--可将粗盐水变为纯净物
D.实验时不用一次性塑料杯--保护环境要从身边小事做起
5.地球是我们赖以生存的美丽家园,人类在生产和生活中的下列活动:①工业“三废”未经处理直接排放;②植树造林,加大绿化面积;③随意丢弃废旧电池和塑料制品垃圾;④生活污水任意排放;⑤减少空气中硫氧化物和氮氧化物的排放,防止形成酸雨。其中能对环境造成污染的是
A.③④⑤ B.②④⑤ C.①②⑤ D.①③④
 日常生活中,我们经常饮用矿泉水。右图是某饮用天然水部分商标图,图中列出了理化指标。据此回答2-3题
日常生活中,我们经常饮用矿泉水。右图是某饮用天然水部分商标图,图中列出了理化指标。据此回答2-3题
2.这里的钙、镁、钾、钠指的是
A.单质 B.原子 C.分子 D.元素
3.这种饮用天然水呈
A.酸性 B.碱性 C.中性 D.无法确定
12.(6分)镁是重要的金属材料,广泛应用于合金、火箭和飞机制造业,世界上大部分镁是从海水中提取的。威海是一座滨海城市,海岸线长达1000 km,海水资源丰富。某校学习小组的同学对家乡附近海水中镁元素的含量进行测定。称取海水100kg,然后再加入足量的氢氧化钠溶液,过滤、干燥、称量后得到沉淀质量见下表。(重复实验三次)。
|
|
第一次实验 |
第二次实验 |
第三次实验 |
|
所取海水质量/kg |
100 |
100 |
100 |
|
生成沉淀质量/kg |
0.28 |
0.29 |
0.30 |
试计算海水中镁元素的质量分数。
(假定海水中镁元素全部以氯化镁的形式存在,不考虑沉淀中杂质的干扰)。
11.(18分)实验与探究:追踪氧气和二氧化碳的足迹
据科学家估计,全世界生物的呼吸和燃烧所消耗的氧气,每秒钟可达l万吨左右。但
是我们生活中并没有明显感到环境中氧气不足,这是什么原因呢?
事实上,把地球作为一个整体,一些化学变化在消耗氧气的同时,另一些变化又在产
生氧气,并且维持一种动态平衡。科学研究发现,地球的再生氧气主要来源于地球臭氧层
电场电流对水分子的电解和绿色植物的光合作用。
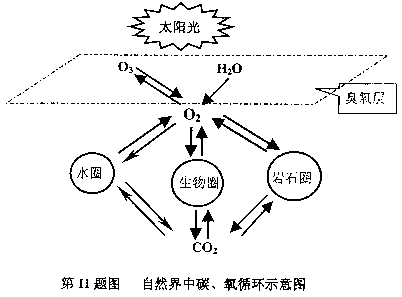 下图是自然界中碳、氧循环的主要途径:
下图是自然界中碳、氧循环的主要途径:
根据上图,运用你学过的有关知识,回答下列问题。
(1)试写出自然界中两种不同类型的消耗氧气的途径
①
②
(2)请你设计一个实验,模拟(1)中消耗氧气的一种变化。将实验方案写在下面。
(3)在实验中,为了获得少量氧气,可以根据物质的性质,选择含有 元素的物质,通过控制反应条件来实现。请你用化学方程式表示在实验室里产生氧气的一个变化
 (4)另外有一种实验室产生少量氧气的简易方法:用过氧化氢的水溶液做反应物,反应条件是常温和二氧化锰做催化剂,反应的化学方程式为
。
(4)另外有一种实验室产生少量氧气的简易方法:用过氧化氢的水溶液做反应物,反应条件是常温和二氧化锰做催化剂,反应的化学方程式为
。
若根据该反应制取氧气,则发生装置跟制取 气体的发生装置相同,需要的仪器有 。与实验室用氯酸钾制取氧气比较,该反应的优点是
。现用溶质质量分数为30%、密度为1.1g/ml的过氧化氢溶液制取氧气。实验中,发现二氧化锰与过氧化氢溶液混合后,装置中产生氧气的速度太快,你认为可能的原因有
。
(5)从图中可以看出,碳和氧的循环过程是紧密联系在一起的一种自然过程。事实上,地球上的碳只有0.9%参与循环,99.1%都固定在岩石圈中,然而,人类对能源和资源的过度开发利用,已经影响到自然界中碳、氧循环。
①在上面叙述中所说中碳、氧循环是指 的循环。
A.碳和氧的单质 B.氧气和二氧化碳 C.碳元素和氧元素
②根据自然界中碳、氧循环示意图,试分别写出一个自然界中产生和消耗二氧化碳气体的化学方程式。
产生二氧化碳的反应
消耗二氧化碳的反应 。
③为了遏制大气中二氧化碳不断增加的趋势,维护好自然界中碳、氧循环,请你提出两点措施 ;
。
10.(4分)下表是不同溶质质量分数的硫酸溶液和氨水与其相应密度的对照表
|
溶液中溶质的质量分数 |
4% |
2% |
16% |
24% |
28 |
|
硫酸溶液的密度(20℃)/g·ml |
1.02 |
1.08 |
1.11 |
1.17 |
1.20 |
|
氨水的密度(20~C)/g·ml |
0.98 |
0.95 |
0.94 |
0.91 |
0.90 |
请你仔细分析上表中的数据,回答下列问题:
(1)从上表可以看出,硫酸溶液的密度大于水的密度,而氨水的密度则小于水的密
度。除此以外,你还能够总结出溶液密度与其溶质的质量分数的变化规律是
。
(2)试从物质定量组成(氨水的溶质为NH3)的角度分析,为什么这两种溶液密度与其溶质的质量分数之间存在这种变化规律?
。
8. (8分)人类对原子结构的认识是逐渐深入的。右图是不同时期科学家提出的原子结构模型。
(8分)人类对原子结构的认识是逐渐深入的。右图是不同时期科学家提出的原子结构模型。
1808年,英国科学家道尔顿提出了原子论。他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割;同一类原子性质相同;不同的原子是以简单的整数比相结合。
1897年,英国科学家汤姆生发现原子中存在电子。1904年汤姆生提出了一个被称为
“西瓜式”结构的原子结构模型,电子就像“西瓜子”一样镶嵌在带正电的“西瓜瓤”中。
电子的发现使人们认识到原子是由更小的粒子构成的。
1911年英国科学家卢瑟福做了一个实验:用一束质量比电子大很多的带正电的高速运
动的。粒子轰击金箔,结果是大多数。粒子能穿过金箔且不改变原来的前进方向,但也有
一小部分改变了原来的方向,还有极少数的。粒子被反弹了回来。据此他提出了带核的原
子结构模型:原子是由原子核和核外电子构成。
……
根据以上材料,请回答:
(1)道尔顿提出了原子论,汤姆生发现了原子中的电子,这在当时是件很了不起的事,但由于受到那时科学技术水平的限制,他们的理论中存在一些缺陷甚至错误,按照目前初中阶段你学的原子结构的理论,你认为道尔顿的原子论存在的缺陷是
;
汤姆生原子结构模型的缺陷是
。
(2)根据卢瑟福的实验所产生的现象,不能够获得的结论是 。
A.原子核体积很小 B.原子核质量较大 C.原子核带有正电 D.核外电子带有负电
(3)通过人类认识原子结构的历史,你对科学的发展有哪些感想?
。

