13.(1)CO2;H2CO3;Fe(OH)3;CH4、C2H5OH(其它答案符合题意也可)
(2)墨的主要成分是碳,在常温下,碳的化学性质是不活泼的,碳受日光照射或跟空气、水分接触,都不易起变化;一氧化碳吸进分肺里跟血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,人体就缺少氧气,发生中毒现象。
(3)2Na2O2+2CO2 = 2Na2CO3+O2
(4)Fe+CuSO4 = FeSO4+Cu
20.(4分)为了对海水中的氯化物(假设以NaCl计算)进行成份分析,甲、乙、丙三位同学分别进行实验,他们的实验数据如下,请仔细观察分析,回答下列问题:
|
|
甲 |
乙 |
丙 |
|
所取海水样品的质量/g |
100 |
50 |
50 |
|
加入AgNO3溶液的质量/g |
50 |
50 |
75 |
|
反应后所得的沉淀物的质量/g |
1.435 |
1.435 |
1.435 |
(1)两溶液恰好完全反应的是_____________的实验。
(2)请计算海水中的氯化物(以氯化钠计算)的质量分数是多少?
中考模拟演练(五)
第I卷(选择题 共18分)
第Ⅱ卷(非选择题 共32分)
19.(2分)一个青少年正常情况下每天约需0.8g钙。若每天从食物中得到0.6g钙,其余由钙片补充,则每天需吃含85%葡萄糖酸钙[(C6H11O7)2Ca]的钙片_________g。(保留两位小数)
18.(4分)二氧化硫在通常情况下是一种无色、有刺激性气味的有毒气体,它能与氢氧化钠溶液反应生成盐和水。现有某一实验小组的同学欲利用下列装置和药品制取二氧化硫,并对二氧化硫与水在通常情况下能否发生化学反应进行实验探究。设计的探究过程如下,请你回答其中的有关问题。
(1)假设:二氧化硫与水在通常情况下能发生化学反应,生成物是一种酸。
(2)设计方案:先验证水能否使蓝色石蕊试纸变色;再验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色;最后验证二氧化硫气体能否使湿润的蓝色石蕊试纸变红。
(3)查阅资料:你认为该研究小组需要查阅的资料内容中应包括__ _填写编号)。
①二氧化硫易溶于水②酸能使湿润的蓝色石蕊试纸变红③二氧化硫能被浓硫酸干燥
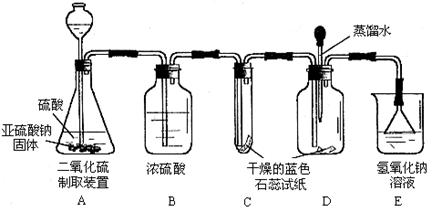
(4)实验:
①实验过程中,装置C内石蕊试纸的颜色始终没有变化,这说明
______________________________________________________。
②装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸发生颜色变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红,此现象说明_______________________________ __________________。
③装置E的作用是____________,写出发生反应的化学方程式___ _________ ____。
(5)结论:原假设____________________________________(填“成立”、“不成立”)。
17.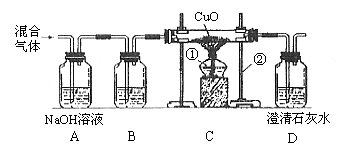 (5分)某课外活动小组利用一氧化碳气体测定CuO的还原率。实验开始时,对参与实验的气体未作任何处理就直接作用,结果测得的CuO的还原率超过了100%,后来经过分析讨论并改进实验装置,改进后的实验装置及测得的实验数据见如下图表:
(5分)某课外活动小组利用一氧化碳气体测定CuO的还原率。实验开始时,对参与实验的气体未作任何处理就直接作用,结果测得的CuO的还原率超过了100%,后来经过分析讨论并改进实验装置,改进后的实验装置及测得的实验数据见如下图表:
|
混合气体的量(g) |
7 |
|
CuO的量(g) |
20 |
|
沉淀的量(g) |
20 |
试回答:
(1)指出图中所标示的仪器的名称:①______________;②______________。
(2)改进实验装置前,用沉淀的量测得的CuO的还原率超过了100%,其可能的原因之一是通入的一氧化碳气体中混有___________气体。
(3)A装置中发生反应的化学方程式是________________ _______。
(4)用改进后的实验装置,若生成的气体在D装置中被完全吸收,则测得的CuO的还原率为___________。
(5)为了保护环境,应在D装置的排气管口采取的措施是_____________________ _。
16.(7分)某校小明等初四年级同学以“某海域海水污染的情况调查”为研究课题开展活动。他们用洁净的矿泉水瓶取回了该海域海水样品,请你和他们组成研究小组,回答下列有关问题。
(1)为较准确测定海水样品的酸碱度,你建议使用什么试剂或试纸 。
(2)由于大量的海产养殖,造成该海域海水中的氮、磷、钾含量过高,从而造成大面积污染。这里的氮、磷、钾是指 (填分子、原子、离子或元素)。
(3)查阅相关文献知道,用于测定磷含量的试剂是钼酸铵,化学式为(NH4)2MoO4,请问钼酸铵中钼(Mo)元素的化合价是 价。
(4)下列所述情况①城市生活污水的任意排放;②农业生产中农药、化肥使用不当;③海上油轮石油泄漏;④工业生产中“三废”无害化处理后再排放;⑤海产养殖。可能引起海水污染的是(填编号)
(5)现要对海水样品进行污染情况的研究,小组设计了以下方案,你认为下列方案不正确的是 。
(A)将海水过滤后,称量不溶物的质量,可测定海水样品中溶质的总质量
(B)使用氯化钡溶液和盐酸,可证明此海水中是否含有硫酸根离子
(C)请教专家后,进行氮、磷、钾含量的测定
(D)与东海域的海水进行对比研究,它们在成分上的差别
(6)研究中需要质量分数为2%的硝酸钾溶液150g,配制过程所必须的仪器有
。
(7)某课外活动小组的研究报告中提出了如下一些设想,你认为不合理的是 。
(A)禁止周边工厂未经处理的废水直接排放到海里
(B)含较多N、P、K等作物营养成分的海水可用其灌溉农作物
(C)禁止在该海域进行大量水产养殖,恢复该海域海区的生态平衡
(D)生活污水排入海洋前要进行较彻底的污水处理
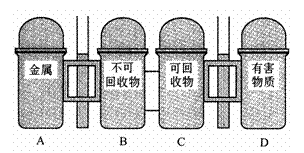 (8)右图是某市街道边新设的垃圾分类箱示意图。当某同学完成实验后,应将装海水样品的空矿泉水瓶放入哪个箱中
。
(8)右图是某市街道边新设的垃圾分类箱示意图。当某同学完成实验后,应将装海水样品的空矿泉水瓶放入哪个箱中
。
(9)某研究小组查阅了某地区《2001年海洋环境公报》得知:该海域的主要污染物是化学需氧量(Chemical Oxygen Demand,简写为COD)、磷、氮、油类、铅和汞等,其中COD是指一定量海水与高锰酸钾或K2Cr2O7发生氧化反应时,所用高锰酸钾或K2Cr2O7的量。据此回答:(注:Cr是铬元素的元素符号)
①受污染的海水含有X物质,它与K2Cr2O7反应的化学方程式为:
X+5K2Cr2O7+20H2SO4=6CO2+5K2SO4+5Cr2(SO4)3+23H2O则X的化学式为: 。
②假设海水中的汞以硝酸汞的形式存在,请写出能证明汞存在的化学方程式:
③你认为这些污染物的主要来源是(填两种):
④海水是资源大宝库,请写出能从未污染的海水中提取或加工得到的物质(请尽你所知写出一种,填名称或化学符号均可)
15.(2分)以你家乡的某条河流或水库或水塘等为背景,由于种种原因,其生态环境遭到了严重的破坏,水被严重污染,对外有损家乡的形象,对内影响了周边居民的生活质量。下面列出了一道研究性学习课题:《河水(水库或水塘)污染情况的调查研究》
该课题作为你的研究性学习课题,请简要列出你的研究计划与研究方法,
研究计划:
研究方法:
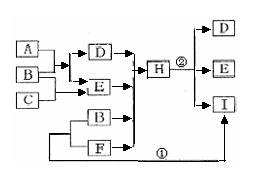
14.(3分)右框图中所涉及的物质均是由C、H、O、Cu四种元素组成的单质或化合物,室温下A、B、C、D是气体,且A是天然气的主要成分,它们相互之间因反应条件不同,能发生反应、剧烈反应或缓慢氧化反应。试根据如图所示的转化关系回答下列问题:
(1)写出下列物质的名称:C. __ _,F. ____。
(2)写出下列反应的化学方程式:
①________________________________;②____________________ _________。
13.(5分)初中学习了氢、氧、碳、铁等元素的单质及化合物的知识。请回答(以下各空均填写化学式):
(1)由H、O、C、Fe组成的常见化合物中,属于酸性氧化物的是______,属于无机含氧酸的是 ,属于碱的是______,属于有机物的是(写两种)_______ ___ 。
(2)我国古代用墨写的字虽年深日久仍不变色,其原因是_______ _____ ______
;冬天用煤火取暖,因排气不良,易发生煤气中毒,一氧化碳使人中毒的原因是________ ___
。
(3)潜水艇中需配备氧气再生装置,利用的是过氧化钠(Na2O2)与二氧化碳(CO2)反应生成碳酸钠和氧气,该反应的化学方程式为___ ____ ________。
(4)早在西汉时期,就有“曾青得铁则化为铜”的记载,其中涉及的反应方程式为
 _ ___________
_______。
_ ___________
_______。

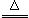 2CuO;②Cu2(OH)2CO3
2CuO;②Cu2(OH)2CO3