2026年金考卷中考45套汇编化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷中考45套汇编化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
6. (2025 沧州模拟)海洋是巨大的资源宝库,海水综合利用的部分工艺流程图如图所示。

(1) 粗盐含有的主要杂质为 MgCl₂、CaCl₂,则固体 B 的主要成分是
(2) 步骤①加入适量盐酸的目的是
(3) 步骤③中反应的化学方程式为
(4) 钛被称为“世纪金属”,广泛应用于火箭、航天飞机和通信设备等。工业上利用步骤④制备金属钛,该反应所属的基本反应类型是

(1) 粗盐含有的主要杂质为 MgCl₂、CaCl₂,则固体 B 的主要成分是
Mg(OH)2
(填化学式)和 CaCO₃。(2) 步骤①加入适量盐酸的目的是
除去过量的氢氧化钠和碳酸钠
。加入适量盐酸后,为了得到氯化钠固体,还需进行的操作是蒸发结晶
。(3) 步骤③中反应的化学方程式为
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
。(4) 钛被称为“世纪金属”,广泛应用于火箭、航天飞机和通信设备等。工业上利用步骤④制备金属钛,该反应所属的基本反应类型是
置换反应
。
答案:
6
(1)$Mg(OH)_2$
(2)除去过量的氢氧化钠和碳酸钠 蒸发结晶
(3)$Mg(OH)_2 + 2HCl \longrightarrow MgCl_2 + 2H_2O$
(4)置换反应

6
(1)$Mg(OH)_2$
(2)除去过量的氢氧化钠和碳酸钠 蒸发结晶
(3)$Mg(OH)_2 + 2HCl \longrightarrow MgCl_2 + 2H_2O$
(4)置换反应

7. 皮蛋是成渝等地人们喜爱的食品,制作流程如图。

资料:1. 草木灰(含 K₂CO₃)中常含有砂石和未燃尽的秸秆等固体。
2. 碱,有涩味,可与蛋白质作用,使其凝固。
请回答下列问题:
(1) 选料:“过筛”的目的是
(2) 调浆:调浆过程发生的复分解反应的化学方程式为
(3) 裹泥:裹泥时,不慎皮肤接触料浆,处理方法为
(4) 封存:需要“密封”的主要原因是减少水分蒸发和
(5) 食用皮蛋时加醋能去除涩味的原因是

资料:1. 草木灰(含 K₂CO₃)中常含有砂石和未燃尽的秸秆等固体。
2. 碱,有涩味,可与蛋白质作用,使其凝固。
请回答下列问题:
(1) 选料:“过筛”的目的是
除去砂石和未燃尽的秸秆等颗粒较大的固体
。(2) 调浆:调浆过程发生的复分解反应的化学方程式为
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH[或K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH]
(写一个)。(3) 裹泥:裹泥时,不慎皮肤接触料浆,处理方法为
用大量清水冲洗
。(4) 封存:需要“密封”的主要原因是减少水分蒸发和
减少空气中二氧化碳与皮蛋表面的碱反应,避免皮蛋制作失败
。(5) 食用皮蛋时加醋能去除涩味的原因是
醋酸能与皮蛋中的碱性物质发生反应
。
答案:
7
(1)除去砂石和未燃尽的秸秆等颗粒较大的固体
(2)$Na_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2NaOH$[或$K_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2KOH$]
(3)用大量清水冲洗
(4)减少空气中二氧化碳与皮蛋表面的碱反应,避免皮蛋制作失败
(5)醋酸能与皮蛋中的碱性物质发生反应
[解题思路]
(2)草木灰的主要成分为碳酸钾,调浆过程中,生石灰与水反应生成氢氧化钙,碳酸钠、碳酸钾均能与氢氧化钙反应,后两个反应均是复分解反应,反应的化学方程式为$Na_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2NaOH$、$K_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2KOH$。
(3)裹泥时,不慎皮肤接触料浆,料浆中含有氢氧化钠和氢氧化钾,具有腐蚀性,处理方法为用大量清水冲洗。
(4)料浆中的氢氧化钠和氢氧化钾暴露在空气中,会和空气中的二氧化碳发生反应而变质,所以需要“密封”的主要原因是减少水分蒸发和减少空气中二氧化碳与皮蛋表面的碱反应,避免皮蛋制作失败。
(5)食用皮蛋时加醋能去除涩味,是因为醋酸能与皮蛋中的碱性物质发生反应。
(1)除去砂石和未燃尽的秸秆等颗粒较大的固体
(2)$Na_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2NaOH$[或$K_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2KOH$]
(3)用大量清水冲洗
(4)减少空气中二氧化碳与皮蛋表面的碱反应,避免皮蛋制作失败
(5)醋酸能与皮蛋中的碱性物质发生反应
[解题思路]
(2)草木灰的主要成分为碳酸钾,调浆过程中,生石灰与水反应生成氢氧化钙,碳酸钠、碳酸钾均能与氢氧化钙反应,后两个反应均是复分解反应,反应的化学方程式为$Na_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2NaOH$、$K_2CO_3 + Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + 2KOH$。
(3)裹泥时,不慎皮肤接触料浆,料浆中含有氢氧化钠和氢氧化钾,具有腐蚀性,处理方法为用大量清水冲洗。
(4)料浆中的氢氧化钠和氢氧化钾暴露在空气中,会和空气中的二氧化碳发生反应而变质,所以需要“密封”的主要原因是减少水分蒸发和减少空气中二氧化碳与皮蛋表面的碱反应,避免皮蛋制作失败。
(5)食用皮蛋时加醋能去除涩味,是因为醋酸能与皮蛋中的碱性物质发生反应。
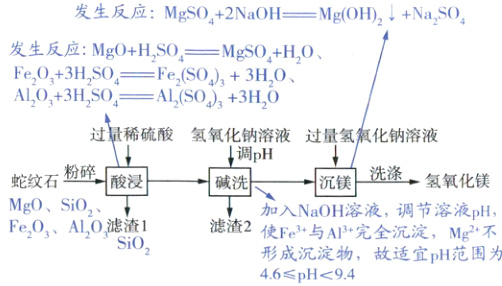
8. 成都盛产蛇纹石,利用蛇纹石生产氢氧化镁的工艺如图。
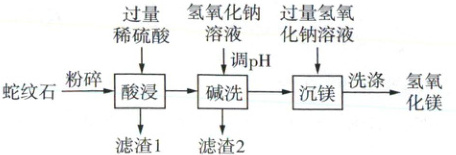
【资料信息】
1. 蛇纹石的主要成分为 MgO 和 SiO₂,含少量 Fe₂O₃、Al₂O₃ 等。
2. SiO₂ 难溶于水,不与稀硫酸反应。
3. 部分金属离子形成氢氧化物沉淀的 pH 范围如下表。

(1) “粉碎”的目的是
(2) “酸浸”后,滤液中阳离子有 Mg²⁺ 和
(3) “碱洗”时,适宜的 pH 范围为
(4) “沉镁”的化学方程式为
(5) “洗涤”时,证明氢氧化镁已洗净的方法是

【资料信息】
1. 蛇纹石的主要成分为 MgO 和 SiO₂,含少量 Fe₂O₃、Al₂O₃ 等。
2. SiO₂ 难溶于水,不与稀硫酸反应。
3. 部分金属离子形成氢氧化物沉淀的 pH 范围如下表。

(1) “粉碎”的目的是
增大反应物间的接触面积,使反应更充分
。(2) “酸浸”后,滤液中阳离子有 Mg²⁺ 和
H+、Fe3+、Al3+
(填符号),滤渣 1 的主要成分是SiO2
。(3) “碱洗”时,适宜的 pH 范围为
4.6 ≤ pH < 9.4
。(4) “沉镁”的化学方程式为
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4
。(5) “洗涤”时,证明氢氧化镁已洗净的方法是
取少量最后一次洗涤液于试管中,滴入氯化钡溶液和无色酚酞溶液,无明显变化,说明已洗净
。
答案:
8
(1)增大反应物间的接触面积,使反应更充分
(2)$H^+$、$Fe^{3+}$、$Al^{3+}$ $SiO_2$
(3)$4.6 \leq pH < 9.4$
(4)$MgSO_4 + 2NaOH \longrightarrow Mg(OH)_2 \downarrow + Na_2SO_4$
(5)取少量最后一次洗涤液于试管中,滴入氯化钡溶液和无色酚酞溶液,无明显变化,说明已洗净
[解题思路]
(5)$Mg(OH)_2$表面可能残留$Na_2SO_4$。要检验是否有$Na_2SO_4$,可检验是否存在$SO_4^{2-}$,可利用$Ba^{2+} + SO_4^{2-} \longrightarrow BaSO_4 \downarrow$的反应;要检验是否有$NaOH$,可加入少量酚酞溶液,观察溶液是否变红。
8
(1)增大反应物间的接触面积,使反应更充分
(2)$H^+$、$Fe^{3+}$、$Al^{3+}$ $SiO_2$
(3)$4.6 \leq pH < 9.4$
(4)$MgSO_4 + 2NaOH \longrightarrow Mg(OH)_2 \downarrow + Na_2SO_4$
(5)取少量最后一次洗涤液于试管中,滴入氯化钡溶液和无色酚酞溶液,无明显变化,说明已洗净
[解题思路]

(5)$Mg(OH)_2$表面可能残留$Na_2SO_4$。要检验是否有$Na_2SO_4$,可检验是否存在$SO_4^{2-}$,可利用$Ba^{2+} + SO_4^{2-} \longrightarrow BaSO_4 \downarrow$的反应;要检验是否有$NaOH$,可加入少量酚酞溶液,观察溶液是否变红。
9. 氧化铜是某种无机胶黏剂的组分之一,工业上制备氧化铜的流程如图所示。

(1) 反应器中进行搅拌的目的是
(2) 反应器中发生反应的基本反应类型是
(3) 设备 1 产生的无色滤液中一定含有的溶质成分为
(4) 加热器中发生反应的化学方程式为

(1) 反应器中进行搅拌的目的是
加快反应速率,使反应充分
。(2) 反应器中发生反应的基本反应类型是
复分解反应
。(3) 设备 1 产生的无色滤液中一定含有的溶质成分为
硫酸钠(或Na2SO4)
,请设计实验方案验证无色滤液中可能含有的溶质成分:取少量滤液于试管中,滴加几滴无色酚酞溶液,若溶液变红,说明含有氢氧化钠
(只写出实验操作和现象)。(4) 加热器中发生反应的化学方程式为
Cu(OH)2 △ CuO + H2O
。
答案:
9
(1)加快反应速率,使反应充分
(2)复分解反应
(3)硫酸钠(或$Na_2SO_4$) 取少量滤液于试管中,滴加几滴无色酚酞溶液,若溶液变红,说明含有氢氧化钠
(4)$Cu(OH)_2 \xlongequal{\triangle} CuO + H_2O$
(1)加快反应速率,使反应充分
(2)复分解反应
(3)硫酸钠(或$Na_2SO_4$) 取少量滤液于试管中,滴加几滴无色酚酞溶液,若溶液变红,说明含有氢氧化钠
(4)$Cu(OH)_2 \xlongequal{\triangle} CuO + H_2O$
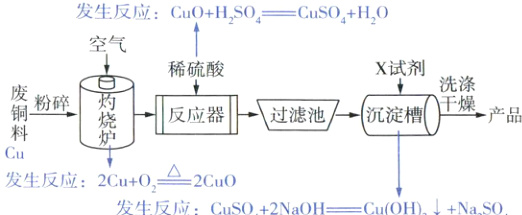
10. 氢氧化铜常用作化学分析试剂,还用于医药、农药等领域。如图是利用废铜料(主要成分是 Cu)生产氢氧化铜粉末的流程图。
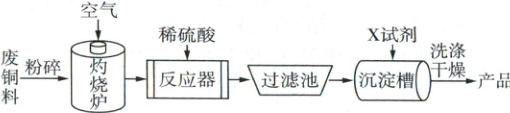
(1) “灼烧炉”中观察到的现象是
(2) “反应器”中发生反应的化学方程式为
(3) 反应器、过滤池及沉淀槽不能用铁制容器的原因是
(4) “沉淀槽”中加入的 X 试剂是

(1) “灼烧炉”中观察到的现象是
红色固体逐渐变成黑色
。(2) “反应器”中发生反应的化学方程式为
CuO + H2SO4 → CuSO4 + H2O
。(3) 反应器、过滤池及沉淀槽不能用铁制容器的原因是
Fe + CuSO4 → Cu + FeSO4
(用化学方程式表示)。(4) “沉淀槽”中加入的 X 试剂是
NaOH溶液(合理即可)
(写一种)。
答案:
10
(1)红色固体逐渐变成黑色
(2)$CuO + H_2SO_4 \longrightarrow CuSO_4 + H_2O$
(3)$Fe + CuSO_4 \longrightarrow Cu + FeSO_4$
(4)NaOH溶液(合理即可)
[解题思路]结合流程图分析如下:
10
(1)红色固体逐渐变成黑色
(2)$CuO + H_2SO_4 \longrightarrow CuSO_4 + H_2O$
(3)$Fe + CuSO_4 \longrightarrow Cu + FeSO_4$
(4)NaOH溶液(合理即可)
[解题思路]结合流程图分析如下:

查看更多完整答案,请扫码查看


