2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
7. (2025·青海海东二模)某磷酸铁锂电池的结构示意图如图,已知放电时的总反应为$ Li_{1 - x}FePO_4 + Li_xC_8 \xlongequal{} LiFePO_4 + 6C $。下列说法正确的是 (

A.充电时,铝箔连接电源负极
B.右侧电解液可用乙醇作溶剂
C.放电时正极的电极反应式为$ Li_{1 - x}FePO_4 + xe^- + xLi^+ \xlongequal{} LiFePO_4 $
D.放电时,电子由铝箔集流器经电解质溶液流向铜箔集流器
C
)
A.充电时,铝箔连接电源负极
B.右侧电解液可用乙醇作溶剂
C.放电时正极的电极反应式为$ Li_{1 - x}FePO_4 + xe^- + xLi^+ \xlongequal{} LiFePO_4 $
D.放电时,电子由铝箔集流器经电解质溶液流向铜箔集流器
答案:
7.C 放电时,$Li^{+}$向左移动,则铝箔为正极、铜箔为负极。放电时铝箔作正极,充电时应与外接电源的正极相连,故A错误;右侧铜箔为负极,Li失电子发生氧化反应,锂能与乙醇反应,右侧电解液不能用乙醇作溶剂,故B错误;放电时,正极发生还原反应,根据总反应$Li_{1-x}FePO_{4}+Li_{x}C_{6}=LiFePO_{4}+6C$,放电时正极的电极反应式为$Li_{1-x}FePO_{4}+xe^{-}+xLi^{+}=LiFePO_{4}$,故C正确;电解质溶液不能传导电子,故D错误;选C。
8. (2025·甘肃二模)全固态锂金属电池具有更高比能和更高安全性。我国科研团队设计了基于 LLZTO@Ag 复合层负极改性的硫化物全固态锂电池,结构如图所示,放电时电池反应为$ Li_{1 - a}Ni_xCo_yMn_zO_2 + aLi \xlongequal{} LiNi_xCo_yMn_zO_2 $。下列说法错误的是 (

A.放电时,电子流向为 a 极→负载→b 极
B.充电时,Li$^+$流向为 b 极→固态电解质→复合层→a 极
C.充电时,b 极的电极反应式为$ LiNi_xCo_yMn_zO_2 - ae^- \xlongequal{} Li_{1 - a}Ni_xCo_yMn_zO_2 + aLi^+ $
D.放电时,每转移 0.1 mol 电子 b 极质量理论上减少 0.7 g
D
)
A.放电时,电子流向为 a 极→负载→b 极
B.充电时,Li$^+$流向为 b 极→固态电解质→复合层→a 极
C.充电时,b 极的电极反应式为$ LiNi_xCo_yMn_zO_2 - ae^- \xlongequal{} Li_{1 - a}Ni_xCo_yMn_zO_2 + aLi^+ $
D.放电时,每转移 0.1 mol 电子 b 极质量理论上减少 0.7 g
答案:
8.D 由图可知,放电时a极为原电池的负极,锂失去电子发生氧化反应生成锂离子,b极为正极,锂离子作用下,$Li_{1-a}Ni_{x}Co_{y}Mn_{z}O_{2}$在正极得到电子发生还原反应生成$LiNi_{x}Co_{y}Mn_{z}O_{2}$;充电时,与直流电源负极相连的a极为阴极,锂离子在阴极得到电子发生还原反应生成锂,b极为阳极,$LiNi_{x}Co_{y}Mn_{z}O_{2}$在阳极失去电子发生氧化反应生成$Li_{1-a}Ni_{x}Co_{y}Mn_{z}O_{2}$和锂离子。由分析可知,放电时a极为原电池的负极,b极为正极,则电子流向为a极$\to$负载$\to$b极,故A正确;由分析可知,充电时与直流电源负极相连的a极为阴极,b极为阳极,则锂离子流向为b极$\to$固态电解质$\to$复合层$\to$a极,故B正确;由分析可知,放电时,b极为正极,锂离子作用下,$Li_{1-a}Ni_{x}Co_{y}Mn_{z}O_{2}$在正极得到电子发生还原反应生成$LiNi_{x}Co_{y}Mn_{z}O_{2}$,则每转移0.1mol电子时,b极增加质量为0.7g,故D错误;故选D。
9. (2025·陕西汉中二模)钠离子电池是一种二次电池,主要依靠钠离子在电极之间移动来工作。一种钠离子电池的工作原理如图所示,放电时电池反应可表示为$ Na_{1 - x}FePO_4 + Na_xC \xlongequal{} NaFePO_4 + C $。下列说法正确的是 (
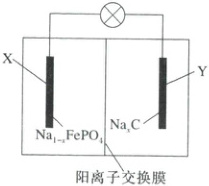
A.电池放电时,X 极发生氧化反应
B.电池放电时,Na$^+$通过阳离子交换膜向右侧区域移动
C.电池充电时,X 极的电极反应式为$ NaFePO_4 + xe^- \xlongequal{} Na_{1 - x}FePO_4 + xNa^+ $
D.电池充电时,每转移 1 mol e$^-$,Y 极质量增加 23 g
D
)
A.电池放电时,X 极发生氧化反应
B.电池放电时,Na$^+$通过阳离子交换膜向右侧区域移动
C.电池充电时,X 极的电极反应式为$ NaFePO_4 + xe^- \xlongequal{} Na_{1 - x}FePO_4 + xNa^+ $
D.电池充电时,每转移 1 mol e$^-$,Y 极质量增加 23 g
答案:
9.D 根据放电时电池反应$Na_{1-x}FePO_{4}+Na_{x}C=NaFePO_{4}+C$可知,放电时$Na_{x}C$失电子,Y是负极;$Na_{1-x}FePO_{4}$得电子发生还原反应,X是正极。由放电时电池反应可知,X极为正极,正极发生还原反应,故A错误;放电时,阳离子移向正极,$Na^{+}$从右侧区域通过阳离子交换膜移向左侧区域,故B错误;充电时,X极为阳极,电极反应式为$NaFePO_{4}-xe^{-}=xNa^{+}+Na_{1-x}FePO_{4}$,故C错误;电池充电时,Y电极为阴极,发生反应$xNa^{+}+xe^{-}+C=Na_{x}C$,则每转移1mol$e^{-}$,Y极质量增加1mol$Na^{+}$,即23g,故D正确;故选D。
10. (2025·沧州二模)一种新型酸碱混合锌铁液流电池放电时的工作原理如图所示。已知 X 和 Y 分别为阳离子膜和阴离子膜,①、②、③区电解质溶液的酸碱性不同。下列说法正确的是 (

A.放电时,a 电极的反应为$ Zn - 2e^- + 4H_2O \xlongequal{} [Zn(OH)_4]^{2 - } + 4H^+ $
B.放电时,Cl$^-$由②区向③区迁移
C.充电时,②区电解质溶液的浓度减小
D.充电时,③区溶液的酸性减弱
C
)
A.放电时,a 电极的反应为$ Zn - 2e^- + 4H_2O \xlongequal{} [Zn(OH)_4]^{2 - } + 4H^+ $
B.放电时,Cl$^-$由②区向③区迁移
C.充电时,②区电解质溶液的浓度减小
D.充电时,③区溶液的酸性减弱
答案:
10.C a极为负极,Zn发生氧化反应生成$[Zn(OH)_{4}]^{2-}$,同时可判断①区电解质溶液呈碱性,b极为正极,$Fe^{3+}$发生还原反应生成$Fe^{2+}$,同时可判断③区电解质溶液呈酸性。放电时,a极为负极,Zn发生氧化反应,电极反应式为$Zn-2e^{-}+4OH^{-}=[Zn(OH)_{4}]^{2-}$,A错误;放电时,b极为正极,$Fe^{3+}$发生还原反应生成$Fe^{2+}$,为保持电解质溶液呈电中性,溶液中阴离子透过阴离子交换膜移向②区,B错误;充电过程中,a电极发生电极反应:$[Zn(OH)_{4}]^{2-}+2e^{-}=Zn+4OH^{-}$,b电极发生电极反应:$2Fe^{2+}-2e^{-}=2Fe^{3+}$,结合离子交换膜种类及电解质溶液保持电中性,$Na^{+}$移向①区,$Cl^{-}$移向③区,②区电解质溶液的浓度减小,C正确;充电时③区溶液的酸性增强,D错误。
11. (2025·湖北省鄂东南示范高中教育联盟高三联考)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂 s - SnLi 可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法错误的是 (


A.放电时,电解质溶液中电流的方向是由 Zn 电极流向另一电极
B.放电时,每生成 1 mol HCOO$^-$,转移$ 2N_A $个电子
C.充电时,Zn 电极周围 pH 降低
D.使用催化剂 Sn 或者 s - SnLi 均能有效减少副产物 CO 的生成
C
)

A.放电时,电解质溶液中电流的方向是由 Zn 电极流向另一电极
B.放电时,每生成 1 mol HCOO$^-$,转移$ 2N_A $个电子
C.充电时,Zn 电极周围 pH 降低
D.使用催化剂 Sn 或者 s - SnLi 均能有效减少副产物 CO 的生成
答案:
11.C 由题干图示信息可知,充电时,阳极反应式为:$4OH^{-}-4e^{-}=O_{2}\uparrow+2H_{2}O$,阴极反应式为:$Zn(OH)_{4}^{2-}+2e^{-}=Zn+4OH^{-}$,则充电时,电池总反应为:$2Zn(OH)_{4}^{2-}\overset{电解}{=}2Zn+4OH^{-}+O_{2}\uparrow+2H_{2}O$,放电时,Zn作负极,电极反应式为:$Zn-2e^{-}+4OH^{-}=Zn(OH)_{4}^{2-}$,另一极为正极,电极反应式为:$CO_{2}+2e^{-}+H_{2}O=HCOO^{-}+OH^{-}$。A项,由分析可知,放电时,Zn为负极,故电解质溶液中电流的方向是由负极即Zn电极流向另一电极即正极,A正确;B项,放电时,正极的电极反应为:$CO_{2}+2e^{-}+H_{2}O=HCOO^{-}+OH^{-}$,则每生成1mol$HCOO^{-}$,转移$2N_{A}$个电子,B正确;C项,充电时,该电极反应式为:$Zn(OH)_{4}^{2-}+2e^{-}=Zn+4OH^{-}$,故Zn电极周围的pH增大,C错误;D项,由图示可知,使用催化剂Sn或者s-SnLi均能使生成CO的活化能增大,且CO具有的能量比HCOOH具有的能量高,则HCOOH更稳定,因此使用催化剂Sn或者s-SnLi可以有效减少副产物CO的生成,D正确;故选C。
查看更多完整答案,请扫码查看


