2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
10.(2025·黑龙江省龙东联盟高三联考)稀有气体化合物在化学、照明、医疗等众多领域有广泛应用,含${Xe}$化合物的种类较多,氙的氟化物(${XeF_{n}}$)与${NaOH}$溶液反应剧烈,与水反应则较为温和,反应方程式如表:

下列说法错误的是 (
A.${OH^{-}}$的还原性比${H_{2}O}$强
B.反应i~iv中有$3$个氧化还原反应
C.反应iv每生成$1\ mol\ {O_{2}}$,转移$4\ mol$电子
D.较${He}$、${Ne}$、${Ar}$、${Kr}$原子,${Xe}$原子半径大,电离能小,所以含${Xe}$的化合物种类更多

下列说法错误的是 (
C
)A.${OH^{-}}$的还原性比${H_{2}O}$强
B.反应i~iv中有$3$个氧化还原反应
C.反应iv每生成$1\ mol\ {O_{2}}$,转移$4\ mol$电子
D.较${He}$、${Ne}$、${Ar}$、${Kr}$原子,${Xe}$原子半径大,电离能小,所以含${Xe}$的化合物种类更多
答案:
10.C A项,由ⅲ、ⅳ两组实验对比可知,在氢氧化钠溶液中,XeF₆可以发生还原反应,而在水中则发生非氧化还原反应,故可知:OH⁻的还原性比H₂O强,A正确;B项,ⅰ、ⅱ、ⅳ三组化学反应均为氧化还原反应,ⅲ组化学反应为非氧化还原反应,B正确;C项,分析ⅳ可知,每生成一个O₂,整个反应转移6个电子,故每生成1molO₂,转移6mol电子,C错误;D项,与同族的0族元素相比,氙原子的最外层虽然为8e⁻稳定结构,但原子半径大,电离能小,所以氙原子的性质相对活泼,形成的化合物种类更多,D正确;故选C。
11.工业上处理含铬(${Cr_{2}O^{2-}_{7}}$)酸性废水有多种方法,其中两种方法如下:
Ⅰ.${含铬酸性废水->[NaHSO_{3}]Cr^{3+}(含\ SO^{2-}_{4}\ 等)->[Ca(OH)_{2}]Cr(OH)_{3}沉淀(含\ CaSO_{4}\ 等沉淀)}$
Ⅱ.${含铬酸性废水->[用铁板作阴、阳极][通电]Cr(OH)_{3}沉淀[含\ Fe(OH)_{3}\ 等沉淀]}$。下列说法
A.${SO^{2-}_{3}}$和${SO^{2-}_{4}}$中的${S}$原子都采用${sp^{3}}$杂化
B.Ⅰ和Ⅱ中,等量的${Cr_{2}O^{2-}_{7}}$发生还原反应时消耗的${H^{+}}$的量不同
C.Ⅰ中参加反应的$\dfrac{n(还原剂)}{n(氧化剂)}=3$
D.Ⅱ中处理含$1\ mol\ {Cr_{2}O^{2-}_{7}}$的废水转移$6\ mol$电子
Ⅰ.${含铬酸性废水->[NaHSO_{3}]Cr^{3+}(含\ SO^{2-}_{4}\ 等)->[Ca(OH)_{2}]Cr(OH)_{3}沉淀(含\ CaSO_{4}\ 等沉淀)}$
Ⅱ.${含铬酸性废水->[用铁板作阴、阳极][通电]Cr(OH)_{3}沉淀[含\ Fe(OH)_{3}\ 等沉淀]}$。下列说法
错
误
的是 (D
)A.${SO^{2-}_{3}}$和${SO^{2-}_{4}}$中的${S}$原子都采用${sp^{3}}$杂化
B.Ⅰ和Ⅱ中,等量的${Cr_{2}O^{2-}_{7}}$发生还原反应时消耗的${H^{+}}$的量不同
C.Ⅰ中参加反应的$\dfrac{n(还原剂)}{n(氧化剂)}=3$
D.Ⅱ中处理含$1\ mol\ {Cr_{2}O^{2-}_{7}}$的废水转移$6\ mol$电子
答案:
11.D SO₃²⁻中S原子的孤电子对数=(6+2-2×3)/2=1,价层电子对数=3+1=4,SO₄²⁻中S原子的孤电子对数=(6+2-2×4)/2=0,价层电子对数=4,二者都采用sp³杂化,A项正确;Ⅰ中Cr₂O₇²⁻发生反应Cr₂O₇²⁻+3HSO₃⁻+5H⁺=2Cr³⁺+3SO₄²⁻+4H₂O,Ⅱ中Cr₂O₇²⁻发生反应Cr₂O₇²⁻+6Fe²⁺+14H⁺=2Cr³⁺+6Fe³⁺+7H₂O,故Ⅰ和Ⅱ中,等量的Cr₂O₇²⁻发生还原反应时消耗的H⁺的量不同,B项正确;由B项解析中的离子方程式可知,Ⅰ中Cr₂O₇²⁻为氧化剂,HSO₃⁻为还原剂,则n(还原剂)/n(氧化剂)=3,C项正确;Ⅱ中电解槽中的阳极发生反应Fe-2e⁻=Fe²⁺,6Fe~6Fe²⁺,失去12e⁻,再发生反应Cr₂O₇²⁻+6Fe²⁺+14H⁺=2Cr³⁺+6Fe³⁺+7H₂O,6Fe²⁺~6Fe³⁺,失去6e⁻,故Ⅱ中处理含1molCr₂O₇²⁻的废水,转移18mol电子,D项错误。
12.(2025·河北保定模拟)二氧化氯(${ClO_{2}}$)是国际上公认的安全、无毒的绿色消毒剂。“R7法”制备二氧化氯的优点是副产品氯气经处理后可循环利用,具体制备流程如图所示。消毒效率$=1\ mol消毒剂的质量÷ 1\ mol消毒剂得电子数$。
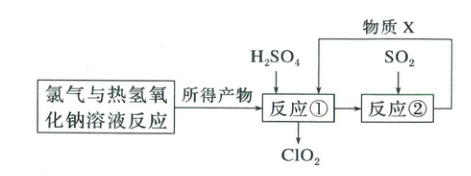
下列说法正确的是 (
A.${ClO_{2}}$和${Cl_{2}}$的消毒效率之比为$71:18$
B.反应①生成${ClO_{2}}$的离子方程式:${2ClO^{-}_{3} + 2Cl^{-} + 4H^{+}\xlongequal{}2ClO_{2}\uparrow + 2H_{2}O + Cl_{2}\uparrow}$
C.反应①消耗的硫酸与反应②生成的硫酸物质的量相等
D.反应②中${SO_{2}}$作还原剂,物质${X}$为${H_{2}SO_{4}}$

下列说法正确的是 (
B
)A.${ClO_{2}}$和${Cl_{2}}$的消毒效率之比为$71:18$
B.反应①生成${ClO_{2}}$的离子方程式:${2ClO^{-}_{3} + 2Cl^{-} + 4H^{+}\xlongequal{}2ClO_{2}\uparrow + 2H_{2}O + Cl_{2}\uparrow}$
C.反应①消耗的硫酸与反应②生成的硫酸物质的量相等
D.反应②中${SO_{2}}$作还原剂,物质${X}$为${H_{2}SO_{4}}$
答案:
12.B 氯气与热氢氧化钠溶液反应生成氯化钠和氯酸钠,向反应后的溶液中加入H₂SO₄生成ClO₂和Cl₂,反应②中Cl₂和SO₂反应生成H₂SO₄和HCl,X为H₂SO₄和HCl的混合物。A.ClO₂中氯元素化合价由+4变为一1时,消毒效率为67.5/5,Cl₂中氯元素化合价由0变为一1时,消毒效率为71/2,则ClO₂和Cl₂的消毒效率之比为67.5/5:71/2=27:71,错误;B.反应①中氯化钠和氯酸钠在酸性条件下发生氧化还原反应生成ClO₂和Cl₂,根据得失电子守恒和电荷守恒配平离子方程式为2ClO₃⁻+2Cl⁻+4H⁺=2ClO₂↑+2H₂O+Cl₂↑,正确;C.反应②中Cl₂和SO₂反应生成H₂SO₄,根据得失电子守恒和质量守恒配平化学方程式为Cl₂+SO₂+2H₂O=H₂SO₄+2HCl,反应①发生反应:2ClO₃⁻+2Cl⁻+4H⁺=2ClO₂↑+2H₂O+Cl₂↑,当反应①生成1molCl₂时,消耗2molH₂SO₄,反应②消耗1molCl₂时,生成1molH₂SO₄,错误;D.由C可知,反应②为Cl₂+SO₂+2H₂O=H₂SO₄+2HCl,S元素化合价上升,SO₂作还原剂,物质X为H₂SO₄和HCl的混合物,错误。
13.微生物在电子供体的作用下可将${Sb( + 5)}$(存在形式为${SbO^{-}_{3}}$)还原为更易被去除的${Sb( + 3)}$,根据电子供体的不同可分为自养还原和异养还原。为去除水中锑($+5$)酸盐,某大学建立升流式硫自养固定床生物反应器,其反应机理如图所示。下列说法正确的是 (
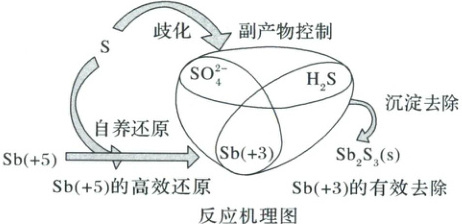
A.在生物反应器中可以实现${S}$单质的循环利用
B.自养还原过程的离子方程式为${3SbO^{-}_{3} + S + 10H^{+}\xlongequal{}SO^{2-}_{4} + 3Sb^{3+} + 5H_{2}O}$
C.歧化过程中,氧化产物与还原产物的物质的量之比为$3:1$
D.${Sb( + 3)}$的沉淀去除过程发生了氧化还原反应
B
)
A.在生物反应器中可以实现${S}$单质的循环利用
B.自养还原过程的离子方程式为${3SbO^{-}_{3} + S + 10H^{+}\xlongequal{}SO^{2-}_{4} + 3Sb^{3+} + 5H_{2}O}$
C.歧化过程中,氧化产物与还原产物的物质的量之比为$3:1$
D.${Sb( + 3)}$的沉淀去除过程发生了氧化还原反应
答案:
13.B 在生物反应器中并没有再重新生成S单质,没有实现S单质的循环利用,A项错误;根据反应机理图可知,自养还原过程的离子方程式为3SbO₃⁻+S+10H⁺=SO₄²⁻+3Sb³⁺+5H₂O,B项正确;根据反应机理图可知,S单质歧化生成硫酸根离子和硫化氢,正确的离子方程式为4S+4H₂O=3H₂S+SO₄²⁻+2H⁺,氧化产物(SO₄²⁻)与还原产物(H₂S)的物质的量之比为1:3,C项错误;Sb(Ⅲ)的沉淀去除过程发生了非氧化还原反应,Sb元素和S元素的化合价均没有发生变化,不属于氧化还原反应,D项错误。
14.几种含碘粒子之间的转化关系如图所示,下列说法正确的是 (
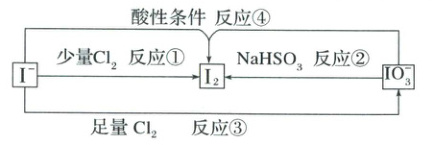
A.${I_{2}}$、${IO^{-}_{3}}$和${Cl_{2}}$的氧化性强弱:${IO^{-}_{3} > Cl_{2} > I_{2}}$
B.为增大${I_{2}}$的产量,反应②可以加过量${NaHSO_{3}}$
C.将淀粉${KI}$溶液逐滴滴入新制氯水中,溶液颜色先变浅后变蓝
D.产生等量的${I_{2}}$,反应④消耗的${H^{+}}$与反应②产生的${H^{+}}$的量相等
C
)
A.${I_{2}}$、${IO^{-}_{3}}$和${Cl_{2}}$的氧化性强弱:${IO^{-}_{3} > Cl_{2} > I_{2}}$
B.为增大${I_{2}}$的产量,反应②可以加过量${NaHSO_{3}}$
C.将淀粉${KI}$溶液逐滴滴入新制氯水中,溶液颜色先变浅后变蓝
D.产生等量的${I_{2}}$,反应④消耗的${H^{+}}$与反应②产生的${H^{+}}$的量相等
答案:
14.C 根据反应①可知氧化性:Cl₂>I₂,根据反应②可知氧化性:IO₃⁻>I₂,根据反应③可知氧化性:Cl₂>IO₃⁻,氧化性:Cl₂>IO₃⁻>I₂,A项错误;过量的NaHSO₃会与碘单质进一步反应,导致碘单质被消耗,B项错误;将淀粉KI溶液逐滴滴入新制氯水中,氯水可将碘离子氧化为碘单质,溶液颜色先变浅后变蓝,C项正确;根据得失电子守恒及电荷守恒,反应④的离子方程式:5I⁻+IO₃⁻+6H⁺=3I₂+3H₂O,反应②的离子方程式:5HSO₃⁻+2IO₃⁻=3H⁺+5SO₄²⁻+I₂+H₂O,产生等量的I₂,反应④消耗的H⁺与反应②产生的H⁺的量不相等,D项错误。
查看更多完整答案,请扫码查看


