2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1.(2024·甘肃卷)$\beta-MgCl_2$晶体中,多个晶胞无隙并置而成的结构如图甲所示,其中部分结构显示为图乙,下列说法错误的是 (
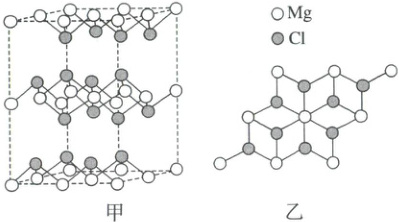
A.电负性:$Mg<Cl$
B.单质$Mg$是金属晶体
C.晶体中存在范德华力
D.$Mg^{2+}$的配位数为 3
D
)
A.电负性:$Mg<Cl$
B.单质$Mg$是金属晶体
C.晶体中存在范德华力
D.$Mg^{2+}$的配位数为 3
答案:
1.D 同周期元素从左到右电负性逐渐增强,电负性:$Mg<Cl$,A项正确;镁为金属元素,单质$Mg$为金属晶体,B项正确;由图甲可知,该晶体中存在层状结构,则层与层之间存在范德华力,C项正确;由图乙中结构可知,与$Mg^{2+}$距离最近且相等的$Cl^-$有6个,故$Mg^{2+}$的配位数为6,D项错误。
2.(2025·四川成都二模)钛金合金可制作装甲,$\beta-$钛金合金具有立方晶胞(如图所示),晶胞参数为$a\ pm$。$Ti-Ti$原子对在每个面的中心处,且平行于立方体的棱边,其间距为$\frac{a}{2}pm$。立方体相邻两面上的$Ti-Ti$原子对互相垂直。下列有关说法错误的是 (
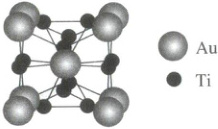
A.这种钛金合金的化学式为$Ti_3Au$
B.每个$Ti$原子周围最近的$Au$原子共有 3 个
C.最邻近的$Ti-Au$原子间距为$\frac{\sqrt{5}}{4}a\ pm$
D.该合金可作装甲是因其硬度比各成分金属的大
B
)
A.这种钛金合金的化学式为$Ti_3Au$
B.每个$Ti$原子周围最近的$Au$原子共有 3 个
C.最邻近的$Ti-Au$原子间距为$\frac{\sqrt{5}}{4}a\ pm$
D.该合金可作装甲是因其硬度比各成分金属的大
答案:
2.B $\beta-钛金$合金具有立方晶胞,$Au$原子位于晶胞顶点及体心,$Ti$原子位于平面上,晶胞中的$Au$原子有$8×\frac{1}{8}+1=2$,$Ti$原子位于每个平面上,有$2×6×\frac{1}{2}=6$个,据此分析;据分析可知,钛金合金的化学式为$Ti_3Au$,A正确;在任一面上的$Ti$为例,该晶胞$Au$原子,最近棱上两个$Au$,加上平行并置晶胞中心的$Au$,共4个,故$Ti$原子周围最近的$Au$原子共有4个,B错误;最邻近的$Ti-Au$原子间距为$Ti$与最近顶点的$Au$距离,计算为$\sqrt{\left(\left(a-\frac{a}{2}\right)\frac{1}{2}\right)^2+\left(\frac{a}{2}\right)^2}=\frac{\sqrt{5}}{4}apm$,C正确;合金硬度比各成分金属的大,故该合金可作装甲,D正确;故选B。
3.(2025·首都师大附中模拟)钛铁基储氢合金是由钛、铁两种元素组成的金属间化合物。一种钛铁合金的晶胞如图 1 所示,该合金吸收的氢位于体心立方八面体的中心,氢原子被 4 个钛原子和 2 个铁原子包围,如图 2 所示。
下列说法不正确的是 (

A.钛铁合金的化学式:$TiFe$
B.钛铁合金中每个$Ti$周围距离最近且等距的$Fe$有 8 个
C.钛铁合金与钛、铁的纯金属相比,熔点更低,硬度更大
D.如图 2 所示的每个体心立方八面体均填充 1 个氢原子,则理论上形成的金属氢化物的化学式:$TiFeH_2$
下列说法不正确的是 (
D
)
A.钛铁合金的化学式:$TiFe$
B.钛铁合金中每个$Ti$周围距离最近且等距的$Fe$有 8 个
C.钛铁合金与钛、铁的纯金属相比,熔点更低,硬度更大
D.如图 2 所示的每个体心立方八面体均填充 1 个氢原子,则理论上形成的金属氢化物的化学式:$TiFeH_2$
答案:
3.D 由图1知,$Ti$位于顶角,$Fe$位于体心,每个晶胞中含有的$Ti$原子个数$=8×\frac{1}{8}=1$,含有的$Fe$原子个数为1,则钛铁合金的化学式为$TiFe$,A正确;由图1知,该晶体中每个$Fe$被8个$Ti$所形成的立方体包围,每个$Ti$亦被8个$Fe$所形成的立方体包围,即钛铁合金中每个$Ti$周围距离最近且相等的$Fe$有8个,B正确;合金与纯金属相比,一般熔点更低,硬度更大,C正确;由图2知,$Ti$位于长方体结构的顶角和棱上,$Fe$位于长方体结构内部,$H$位于体心和面上,每个长方体结构中含有的$Ti$原子个数$=8×\frac{1}{8}+4×\frac{1}{4}=2$,含有的$Fe$原子个数为2,含有的$H$原子个数$=10×\frac{1}{2}+1=6$,原子个数比为$Ti:Fe:H=2:2:6=1:1:3$,则理论上形成的金属氢化物的化学式:$TiFeH_3$,D错误。
4.(2025·无锡匡园双语学校模拟)利用反应$CCl_4+4Na\xlongequal[973\ K]{Ni-Co}C(金刚石)+4NaCl$可实现人工合成金刚石。已知$NaCl$、钠的晶胞如下图所示:
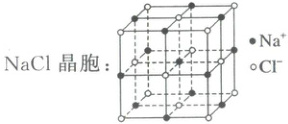

下列关于该反应的说法错误的是 (
A.$C(金刚石)$属于共价晶体
B.$Na$晶胞中有 2 个钠原子
C.$CCl_4$和$C(金刚石)$中的$C$的杂化方式相同
D.$NaCl$晶体中每个$Cl^-$周围有 8 个$Na^+$


下列关于该反应的说法错误的是 (
D
)A.$C(金刚石)$属于共价晶体
B.$Na$晶胞中有 2 个钠原子
C.$CCl_4$和$C(金刚石)$中的$C$的杂化方式相同
D.$NaCl$晶体中每个$Cl^-$周围有 8 个$Na^+$
答案:
4.D C(金刚石)属于共价晶体,A正确;$Na$晶胞中钠位于顶角和体心,则$Na$晶胞中有2个钠原子,B正确;$CCl_4$中心原子价层电子对数为4,杂化方式为$sp^3$杂化,C(金刚石)中的$C$的杂化方式为$sp^3$杂化,两者杂化方式相同,C正确;$NaCl$晶体中每个$Cl^-$周围有6个$Na^+$,D错误。
5.(2025·四川德阳二模)$NiO$和$FeO$的晶体结构[M 点原子坐标为$(0,0,0)$]均与$NaCl$相同。$NiO$的熔点高于$FeO$,$NiO$晶体在氧气中加热时部分$Ni^{2+}$被氧化为$Ni^{3+}$,晶体结构产生缺陷,其组成变为$Ni_xO$,测得其晶胞边长为$a\ pm$,密度为$\rho g· cm^{-3}$。下列说法错误的是 (

A.N 的原子坐标为$(1,1,\frac{1}{2})$
B.离子半径:$Ni^{2+}<Fe^{2+}$
C.$NiO$晶体中,距离$Ni^{2+}$最近的$O^{2-}$围成的空隙为正四面体
D.$Ni_xO$晶体中,$x=\frac{\alpha^3×10^{-30}× N_A-64}{236}$(设$N_A$为阿伏加德罗常数的值)
C
)
A.N 的原子坐标为$(1,1,\frac{1}{2})$
B.离子半径:$Ni^{2+}<Fe^{2+}$
C.$NiO$晶体中,距离$Ni^{2+}$最近的$O^{2-}$围成的空隙为正四面体
D.$Ni_xO$晶体中,$x=\frac{\alpha^3×10^{-30}× N_A-64}{236}$(设$N_A$为阿伏加德罗常数的值)
答案:
5.C 由于该晶体结构与$NaCl$相同,M点原子坐标为$(0,0,0)$,N点在晶胞边的一半处,其原子坐标为$(1,1,\frac{1}{2})$,该选项正确;$Ni^{2+}$和$Fe^{2+}$电子层数相同,$Ni^{2+}$的核电荷数比$Fe^{2+}$大,对核外电子的吸引能力更强,所以离子半径$Ni^{2+}<Fe^{2+}$,该选项正确;$NiO$晶体结构与$NaCl$相同,$NaCl$中每个$Na^+$周围最近的$Cl^-$有6个,围成正八面体,那么$NiO$晶体中距离$Ni^{2+}$最近的$O^{2-}$有6个,围成的是正八面体,不是正四面体,该选项错误;晶胞中$O^{2-}$的个数$=12×\frac{1}{4}+1=4$,$Ni^{2+}$的个数$=6×\frac{1}{2}+8×\frac{1}{8}=4$,根据密度公式$\rho=\frac{m}{V}$,晶胞体积$V=(a×10^{-10})^3cm^3$,设1mol晶胞中$Ni$原子的物质的量为$x$mol,$O$原子的物质的量为1mol,则晶胞质量$m=\frac{(59x+16)×4}{N_A}g$,$\rho=\frac{(59x+16)×4}{(a×10^{-10})^3N_A}$,整理可得$x=\frac{\rho a^3×10^{-30}× N_A-64}{236}$,该选项正确;综上所述,答案是C。
查看更多完整答案,请扫码查看


