2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1.(2024·江苏卷)明矾${[KAl(SO_{4})_{2}· 12H_{2}O]}$可用作净水剂。下列说法正确的是(
A.半径:$r{(Al^{3+})} > r{(K^{+})}$
B.电负性:$\chi {(O)} > \chi {(S)}$
C.沸点:${H_{2}S} > {H_{2}O}$
D.碱性:${Al(OH)_{3}} > {KOH}$
B
)A.半径:$r{(Al^{3+})} > r{(K^{+})}$
B.电负性:$\chi {(O)} > \chi {(S)}$
C.沸点:${H_{2}S} > {H_{2}O}$
D.碱性:${Al(OH)_{3}} > {KOH}$
答案:
1.B A项,$Al^{3+}$有2个电子层,而$K^+$有3个电子层,因此,$K^+$的半径较大,A错误;B项,同一主族的元素,其电负性从上到下依次减小,$O$和$S$都是Ⅵ$A$的元素,$O$元素的电负性较大,B正确;C项,虽然$H_2S$的相对分子质量较大,但是$H_2O$分子间可形成氢键,因此$H_2O$的沸点较高,C错误;D项,元素的金属性越强,其最高价的氧化物的水化物的碱性越强,$K$的金属性强于$Al$,因此$KOH$的碱性较强,D错误;故选B。
2.(2024·重庆卷)某合金含${Mg}$、${Al}$、${Si}$、${Mn}$和${Cu}$等元素。下列说法正确的是(
A.${Si}$的电负性大于${Al}$
B.${Mn}$和${Cu}$均为${d}$区元素
C.${Mg}$的第一电离能小于${Al}$
D.基态时,${Mg}$原子和${Mn}$原子的单电子数相等
A
)A.${Si}$的电负性大于${Al}$
B.${Mn}$和${Cu}$均为${d}$区元素
C.${Mg}$的第一电离能小于${Al}$
D.基态时,${Mg}$原子和${Mn}$原子的单电子数相等
答案:
2.A A项,同周期从左到右元素的电负性逐渐增大,$Si$的电负性大于$Al$,A正确;B项,基态$Mn$原子核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5}4s^{2}$,为$d$区元素;基态$Cu$原子核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^{1}$,为$ds$区元素,B错误;C项,基态$Mg$原子的价电子排布式为$3s^{2}$,基态$Al$原子的价电子排布式为$3s^{2}3p^{1}$,镁原子最外层$3s$轨道达到全充满结构,铝的$3p$轨道未达到半充满结构,故镁的第一电离能大于铝的第一电离能,C错误;D项,基态$Mg$原子的价电子排布式为$3s^{2}$,没有单电子,基态$Mn$价电子排布式为$3d^{5}4s^{2}$,有5个单电子,单电子数不相等,D错误;故选A。

下列说法正确的是(
C
)A.苄氯是非极性分子
B.电负性:$\chi {(F)} < \chi {(Cl)}$
C.离子半径:$r{(F^{-})} > r{(Na^{+})}$
D.${X}$中15-冠-5与${Na^{+}}$间存在离子键
答案:
3.C 由题给结构简式可知,苄氯为极性分子,A错误;同主族元素从上到下电负性逐渐减小,故电负性:$\chi(F)>\chi(Cl)$,B错误;$F^-$、$Na^+$核外电子排布相同,则核电荷数越大,离子半径越小,故$r(F^-)>r(Na^+)$,C正确;$X$属于超分子,超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体,故$X$中15 - 冠 - 5与$Na^+$间存在分子间作用力,D错误。
4.(2025·甘肃卷)我国科学家制备了具有优良双折射性能的${C_{3}H_{8}N^{2+}_{6}· 3H_{2}O}$材料。${NH_{2}}$ ${H}$ ${+}$ ${N}$ ${+}$ ${H}$ ${H_{2}N}$ ${N}$ ${NH_{2}}$ ${· 2I^{-}_{3}}$ ${C_{3}H_{8}N^{2+}_{6}}$
下列说法正确的是(
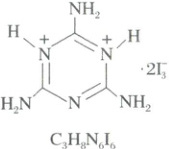
A.电负性${N} < {C} < {O}$
B.原子半径${C} < {N} < {O}$
C.${I^{-}_{3}}$中所有${I}$的孤电子对数相同
D.${C_{3}H_{8}N^{2+}_{6}}$中所有${N-H}$极性相同
下列说法正确的是(
C
)
A.电负性${N} < {C} < {O}$
B.原子半径${C} < {N} < {O}$
C.${I^{-}_{3}}$中所有${I}$的孤电子对数相同
D.${C_{3}H_{8}N^{2+}_{6}}$中所有${N-H}$极性相同
答案:
4.C $I_3^-$中中心$I$原子的孤电子对数=$\frac{1}{2}$×(7 + 1 - 2 × 1)=3,两侧$I$原子各提供1个电子形成$\sigma$键,剩余6个电子构成3个孤电子对,故$I_3^-$中每个$I$的孤电子对数均为3,C正确;同周期主族元素从左到右,电负性逐渐增大,故电负性:$C<N<O$,A错误;电子层数相同的原子,核电荷数越大,半径越小,故原子半径:$C>N>O$,B错误;$N^+$带正电,吸电子能力更强,故$H - N$键极性大,与$—NH_2$中$N - H$键的极性不同,D错误。
5.(2025·甘肃普通高中三模)原子序数依次增大的短周期主族元素${X}$、${Y}$、${W}$在周期表中的位置如图,基态${W}$原子核外有$7$个原子轨道存在电子,${Z}$的原子半径在短周期主族元素中最大。下列说法正确的是(

A.第一电离能:${Y} > {X} > {W}$
B.简单氢化物的热稳定性:${X} > {Y}$
C.${Y}$形成的常见氢化物均为极性分子
D.${Z}$分别与${X}$、${Y}$形成的二元化合物中均只能存在离子键
C
)
A.第一电离能:${Y} > {X} > {W}$
B.简单氢化物的热稳定性:${X} > {Y}$
C.${Y}$形成的常见氢化物均为极性分子
D.${Z}$分别与${X}$、${Y}$形成的二元化合物中均只能存在离子键
答案:
5.C 基态$W$原子核外有7个原子轨道存在电子,$Z$的原子半径在短周期主族元素中最大,再结合这些元素在周期表中的位置及题干可知: $X$、$Y$、$Z$、$W$分别为$N$、$O$、$Na$、$Al$。氮元素的第一电离能比氧元素大,A项错误;非金属性越强,气态氢化物越稳定,故氨气的稳定性比水的弱,B项错误;$Y$为氧元素,水分子、双氧水分子等都是极性分子,C项正确;过氧化钠、叠氮化钠中均含有共价键,D项错误。
6.(2025·山东滨州二模)原子序数依次增大的${X}$、${Y}$、${Z}$三种元素位于不同的短周期,其组成的化合物结构如图。下列说法错误的是(
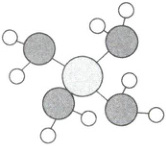
A.电负性:${Y} > {X} > {Z}$
B.简单氢化物的沸点:${Y} > {Z}$
C.最高价含氧酸的酸性:${Z} > {Y}$
D.${Y}$、${Z}$组成的化合物可能为共价晶体
C
)
A.电负性:${Y} > {X} > {Z}$
B.简单氢化物的沸点:${Y} > {Z}$
C.最高价含氧酸的酸性:${Z} > {Y}$
D.${Y}$、${Z}$组成的化合物可能为共价晶体
答案:
6.C 原子序数依次增大的$X$、$Y$、$Z$三种元素位于不同的短周期,即分别位于第一、二、三周期,则原子半径依次增大,所以由图可知,白球为$X$,只能形成1个共价键,则$X$为$H$元素;黑球为$Y$,形成3个共价键,则$Y$为$N$元素;灰球为$Z$,形成4个共价键,则$Z$为$Si$元素,据此解答。$X$为$H$元素,$Y$为$N$元素,$Z$为$Si$元素,$SiH_4$中$Si$、$H$元素化合价分别为 + 4、 - 1,则$Si$、$H$原子间的共用电子对偏离$Si$原子而偏向$H$原子,即电负性:$H>Si$,同理根据$NH_3$可得电负性:$N>H$,所以电负性:$N>H>Si$,即$Y>X>Z$,A正确;$Y$为$N$元素,$Z$为$Si$元素,因$N$元素的电负性很大,$NH_3$分子间存在氢键,$SiH_4$分子间不存在氢键,则简单氢化物的沸点:$NH_3>SiH_4$,即$Y>Z$,B正确;$Y$为$N$元素,$Z$为$Si$元素,同周期主族元素从左到右,非金属性依次增大,同主族元素从上到下,非金属性依次减弱,则非金属性:$N>Si$,元素的非金属性越强,最高价含氧酸的酸性越强,则最高价含氧酸的酸性:$HNO_3>H_2SiO_3$,即$Y>Z$,C错误;$Y$为$N$元素,$Z$为$Si$元素,$N$、$Si$组成的化合物可能为共价晶体,如$Si_3N_4$,D正确;故选C。
7.(2025·广东茂名一模)化合物${XYZ_{2}W_{6}}$为翡翠的主要成分,${W}$、${X}$、${Y}$和${Z}$为原子序数依次增大的短周期主族元素。基态${W}$原子的价层电子排布式为$n{s}^{n}n{p}^{2n}$,${Y}$的基态原子核外电子共占据$7$个原子轨道,${Z}$的最高正化合价和最低负化合价的绝对值相等。下列说法中正确的是(
A.简单离子半径:${X} > {Y} > {W}$
B.最高价氧化物对应水化物的碱性:${X} < {Y}$
C.${X}$和${Y}$的第一电离能均小于同周期相邻元素
D.${ZW^{3-}_{3}}$的空间构型为三角锥形
C
)A.简单离子半径:${X} > {Y} > {W}$
B.最高价氧化物对应水化物的碱性:${X} < {Y}$
C.${X}$和${Y}$的第一电离能均小于同周期相邻元素
D.${ZW^{3-}_{3}}$的空间构型为三角锥形
答案:
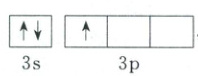
7.C $W$、$X$、$Y$和$Z$为原子序数依次增大的短周期主族元素,其中基态$W$原子的价层电子排布式为$ns^{n}np^{2n}$,$s$能级填充满可以容纳2个电子,即$n = 2$,其价层电子排布式为$2s^{2}2p^{4}$,故$W$为$O$元素;$Z$的最高正化合价和最低负化合价的绝对值相等,其原子序数大于$W$(氧),只能是处于Ⅳ$A$族,可知$Z$为$Si$元素;$Y$的基态原子核外电子共占据7个原子轨道,其核外电子排布图为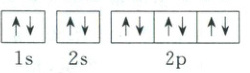
,故$Y$为$Al$元素;由化学式 “$XAlSi_2O_6$”可知,$X$表现 + 1价,其中原子序数大于$W$(氧),故$X$为$Na$元素。由分析可知,$W$为$O$元素、$X$为$Na$元素、$Y$为$Al$元素、$Z$为$Si$元素;电子层结构相同的离子,核电荷数越大,离子半径越小,则简单离子半径:$W(O^{2 - })>X(Na^+)>Y(Al^{3 + })$,故A错误;金属性越强,其最高价氧化物对应水化物的碱性越强,而金属性:$Na>Al$,则最高价氧化物对应水化物的碱性:$NaOH>Al(OH)_3$,故B错误;$Na$的第一电离能小于$Mg$,$Al$的第一电离能小于$Mg$和Si故C正确;$SiO_3^{2 - }$的中心原子$Si$原子孤电子对数=$\frac{4 + 2 - 2×3}{2}=0$、价层电子对数 = 0 + 3 = 3,$SiO_3^{2 - }$的空间构型为平面三角形,故D错误;故选C。
7.C $W$、$X$、$Y$和$Z$为原子序数依次增大的短周期主族元素,其中基态$W$原子的价层电子排布式为$ns^{n}np^{2n}$,$s$能级填充满可以容纳2个电子,即$n = 2$,其价层电子排布式为$2s^{2}2p^{4}$,故$W$为$O$元素;$Z$的最高正化合价和最低负化合价的绝对值相等,其原子序数大于$W$(氧),只能是处于Ⅳ$A$族,可知$Z$为$Si$元素;$Y$的基态原子核外电子共占据7个原子轨道,其核外电子排布图为


,故$Y$为$Al$元素;由化学式 “$XAlSi_2O_6$”可知,$X$表现 + 1价,其中原子序数大于$W$(氧),故$X$为$Na$元素。由分析可知,$W$为$O$元素、$X$为$Na$元素、$Y$为$Al$元素、$Z$为$Si$元素;电子层结构相同的离子,核电荷数越大,离子半径越小,则简单离子半径:$W(O^{2 - })>X(Na^+)>Y(Al^{3 + })$,故A错误;金属性越强,其最高价氧化物对应水化物的碱性越强,而金属性:$Na>Al$,则最高价氧化物对应水化物的碱性:$NaOH>Al(OH)_3$,故B错误;$Na$的第一电离能小于$Mg$,$Al$的第一电离能小于$Mg$和Si故C正确;$SiO_3^{2 - }$的中心原子$Si$原子孤电子对数=$\frac{4 + 2 - 2×3}{2}=0$、价层电子对数 = 0 + 3 = 3,$SiO_3^{2 - }$的空间构型为平面三角形,故D错误;故选C。
8.(2025·广东顺德一模)化合物${(YX_{4})_{2}Q(RZ_{4})_{2}}$可作电镀液的制备原料,已知所含的$5$种元素${X}$、${Y}$、${Z}$、${R}$、${Q}$原子序数依次增大,且在前四周期均有分布,仅有${Y}$与${Z}$同周期。${Z}$与${R}$同族,${Z}$在地壳中含量最高,基态${Q^{+}}$离子的${M}$层为全满。下列说法正确的是(
A.简单氢化物的沸点:${R} > {Z} > {Y}$
B.第一电离能:${Y} < {Z} < {R}$
C.${Q}$与${R}$反应可生成${QR}$
D.键角:${YX^{-}_{3}} > {X_{2}Z} > {X_{2}R}$
D
)A.简单氢化物的沸点:${R} > {Z} > {Y}$
B.第一电离能:${Y} < {Z} < {R}$
C.${Q}$与${R}$反应可生成${QR}$
D.键角:${YX^{-}_{3}} > {X_{2}Z} > {X_{2}R}$
答案:
8.D 元素$X$、$Y$、$Z$、$R$、$Q$原子序数依次增大,且在前四周期均有分布,说明$X$为$H$元素,$Z$在地壳中含量最高是$O$元素,$Z$与$R$同族说明$R$是$S$元素,基态$Q^+$离子的$M$层为全满说明$Q$是$Cu$元素,$Y$与$Z$同周期,结合化合物的化学式为$(YX_4)_2Q(RZ_4)_2$,$Y$为$N$元素,综上所述,$X$、$Y$、$Z$、$R$、$Q$分别为$H$、$N$、$O$、$S$、$Cu$。$Y$为$N$,$Z$为$O$,$R$为$S$,$NH_3$、$H_2O$分子间均有氢键,水分子间氢键强于氨分子间,故简单氢化物的沸点:$H_2O>NH_3>H_2S$,A错误;$Y$为$N$,$Z$为$O$,$R$为$S$,同周期从左往右第一电离能呈增大趋势,$N$原子$2p$轨道半充满稳定,第一电离能大于$O$,同主族从上到下第一电离能逐渐减小,故第一电离能:$S<O<N$,B错误;$Q$为$Cu$,$R$为$S$,$Cu$与$S$反应生成$Cu_2S$,C错误;$NH_3$、$H_2O$、$H_2S$的中心原子均为$sp^3$杂化,$N$原子有1对孤电子对,$O$和$S$有2对孤电子对,$NH_3$键角最大,$O$的电负性大于$S$,成键电子对离中心原子近,斥力更大,$H_2O$的键角更大,故键角:$NH_3>H_2O>H_2S$,D正确;答案选D。
9.(2025·江西名校联盟联考)日光灯中用到的某种荧光粉的主要成分为${3W_{3}(ZX_{4})_{2}· WY_{2}}$。已知:${X}$、${Y}$、${Z}$和${W}$为原子序数依次增大的前$20$号元素,${W}$为金属元素,基态${X}$原子${s}$轨道上的电子数和${p}$轨道上的电子数相等,基态${X}$、${Y}$、${Z}$原子的未成对电子数之比为$2:1:3$。下列说法正确的是(
A.电负性:${Y} < {X} < {Z} < {W}$
B.原子半径:${X} < {Y} < {Z} < {W}$
C.${Y}$和${W}$形成的单质均能与水反应生成气体
D.${Z}$元素最高价氧化物对应的水化物是一种强酸
C
)A.电负性:${Y} < {X} < {Z} < {W}$
B.原子半径:${X} < {Y} < {Z} < {W}$
C.${Y}$和${W}$形成的单质均能与水反应生成气体
D.${Z}$元素最高价氧化物对应的水化物是一种强酸
答案:
9.C 根据基态$X$原子$s$轨道上的电子数与$p$轨道上的电子数相等,可以推测$X$为$O$元素或$Mg$元素;由荧光粉的结构可知,$X$主要形成的是酸根阴离子,因此$X$为$O$元素;基态$O$原子中未成对电子数为2,又因基态$X$、$Y$、$Z$原子的未成对电子数之比为2:1:3,因此$Y$的未成对电子数为1,$X$、$Y$、$Z$、$W$的原子序数依次增大,故$Y$可能为$F$元素、$Na$元素、$Al$元素、$Cl$元素;因$W$为金属元素且荧光粉的结构中$Y$与$W$化合,故$Y$为$F$元素或$Cl$元素;$Z$原子的未成对电子数为3,又因其原子序数大于$Y$,故$Y$应为$F$元素、$Z$应为$P$元素;从荧光粉的结构可以看出该物质中$W$为 + 2价,故其为$Ca$元素。同一周期从左到右元素的电负性依次增大,同一主族从上到下元素的电负性依次减小,则电负性:$Ca<P<O<F$,A错误;同一周期主族元素从左到右原子半径依次减小,同一主族元素从上到下原子半径依次增大,则原子半径:$F<O<P<Ca$,B错误;$F_2$与水反应生成$HF$气体和$O_2$,$Ca$与水反应生成氢氧化钙和氢气,C正确;$H_3PO_4$不是强酸,D错误。
查看更多完整答案,请扫码查看


