1. 在反应$X+2Y\xlongequal{}R+2M$中(化学方程式已配平),已知R和M的相对分子质量之比为22∶9,当1.6 g X与Y完全反应后,生成4.4 g R。则在此反应中Y和M的质量之比为( )
A.16∶9
B.23∶9
C.32∶9
D.46∶9
A.16∶9
B.23∶9
C.32∶9
D.46∶9
答案:
A
2. 在反应$A+3B\xlongequal{}2C+3D$中,已知2.3 g A跟4.8 g B恰好完全反应生成4.4 g C。又知D的式量为18,则A的式量为( )
A.23
B.46
C.92
D.96
A.23
B.46
C.92
D.96
答案:
B
3. 将一定量的丙醇($C_{3}H_{8}O$)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如表所示:
| 物 质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |
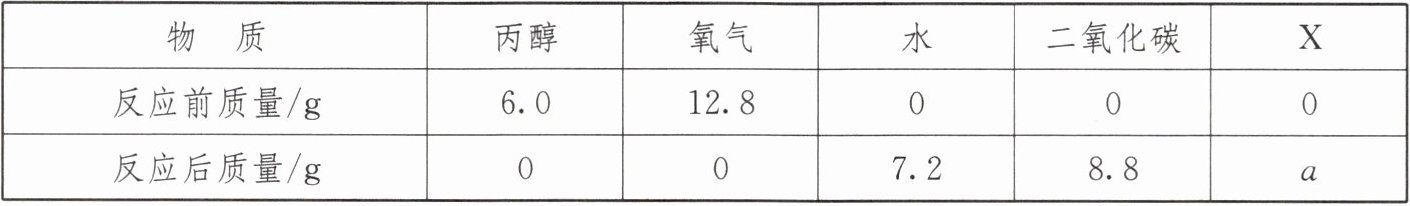
下列判断正确的是( )
A.表中a的值为3.8
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若起始时氧气的质量是14.4 g,则无X生成
| 物 质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |

下列判断正确的是( )
A.表中a的值为3.8
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若起始时氧气的质量是14.4 g,则无X生成
答案:
解:
1. 计算a的值
根据质量守恒定律:
$6.0 + 12.8 = 7.2 + 8.8 + a$
解得:$a = 2.8$,A错误。
2. 判断X是否为催化剂
X反应前质量为0,反应后为2.8g,质量增加,是生成物,B错误。
3. 判断X是否含氢元素
丙醇中氢元素质量:$6.0g × \frac{8}{60} = 0.8g$
水中氢元素质量:$7.2g × \frac{2}{18} = 0.8g$
氢元素完全转化为水,X中不含氢元素,C错误。
4. 判断氧气14.4g时是否生成X
丙醇完全燃烧化学方程式:$2C_3H_8O + 9O_2 \xlongequal{点燃} 6CO_2 + 8H_2O$
丙醇与氧气质量比:$(2 × 60) : (9 × 32) = 120 : 288 = 5 : 12$
6.0g丙醇需氧气:$6.0g × \frac{12}{5} = 14.4g$,恰好完全燃烧,无X生成,D正确。
结论:D
1. 计算a的值
根据质量守恒定律:
$6.0 + 12.8 = 7.2 + 8.8 + a$
解得:$a = 2.8$,A错误。
2. 判断X是否为催化剂
X反应前质量为0,反应后为2.8g,质量增加,是生成物,B错误。
3. 判断X是否含氢元素
丙醇中氢元素质量:$6.0g × \frac{8}{60} = 0.8g$
水中氢元素质量:$7.2g × \frac{2}{18} = 0.8g$
氢元素完全转化为水,X中不含氢元素,C错误。
4. 判断氧气14.4g时是否生成X
丙醇完全燃烧化学方程式:$2C_3H_8O + 9O_2 \xlongequal{点燃} 6CO_2 + 8H_2O$
丙醇与氧气质量比:$(2 × 60) : (9 × 32) = 120 : 288 = 5 : 12$
6.0g丙醇需氧气:$6.0g × \frac{12}{5} = 14.4g$,恰好完全燃烧,无X生成,D正确。
结论:D
4. 实验室常用石灰石和稀盐酸制取二氧化碳,现取含碳酸钙80%的石灰石12.5 g和94.4 g稀盐酸恰好完全反应(石灰石中的杂质不溶于水,也不与稀盐酸反应)。已知:$CaCO_{3}+2HCl\xlongequal{}CaCl_{2}+H_{2}O+CO_{2}\uparrow$。求:
(1)生成二氧化碳的质量。
(2)恰好完全反应后所得溶液中溶质的质量分数。
(1)生成二氧化碳的质量。
(2)恰好完全反应后所得溶液中溶质的质量分数。
答案:
解:(1)石灰石中碳酸钙的质量为:$12.5g×80\% = 10g$。
设生成二氧化碳的质量为$x$,生成氯化钙的质量为$y$。
$\begin{aligned}CaCO_{3}+2HCl&=CaCl_{2}+H_{2}O+CO_{2}\uparrow \\100& \quad 111 \quad \quad \quad 44 \\10g& \quad y \quad \quad \quad x \\frac{100}{44}&=\frac{10g}{x} \\x&=4.4g\end{aligned}$
(2)$\begin{aligned}\frac{100}{111}&=\frac{10g}{y} \\y&=11.1g\end{aligned}$
反应后溶液的质量为:$10g + 94.4g - 4.4g=100g$。
所得溶液中溶质的质量分数为:$\frac{11.1g}{100g}×100\% = 11.1\%$。
(1)生成二氧化碳的质量为$4.4g$;(2)恰好完全反应后所得溶液中溶质的质量分数为$11.1\%$。
设生成二氧化碳的质量为$x$,生成氯化钙的质量为$y$。
$\begin{aligned}CaCO_{3}+2HCl&=CaCl_{2}+H_{2}O+CO_{2}\uparrow \\100& \quad 111 \quad \quad \quad 44 \\10g& \quad y \quad \quad \quad x \\frac{100}{44}&=\frac{10g}{x} \\x&=4.4g\end{aligned}$
(2)$\begin{aligned}\frac{100}{111}&=\frac{10g}{y} \\y&=11.1g\end{aligned}$
反应后溶液的质量为:$10g + 94.4g - 4.4g=100g$。
所得溶液中溶质的质量分数为:$\frac{11.1g}{100g}×100\% = 11.1\%$。
(1)生成二氧化碳的质量为$4.4g$;(2)恰好完全反应后所得溶液中溶质的质量分数为$11.1\%$。
查看更多完整答案,请扫码查看


