1. 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可以实现如图所示的所有反应,若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
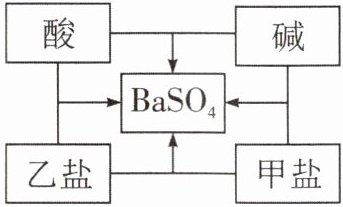
A.HCl、NaOH、$BaCl_2、$$Na_2SO_4$
B.HCl、$Ba(OH)_2、$$Na_2SO_4、$$BaCl_2$
C.H_2SO_4、$$Ba(OH)_2、$$Na_2SO_4、$$BaCl_2$$
$D.H_2SO_4、$NaOH、$BaCl_2、$$Na_2SO_4$

A.HCl、NaOH、$BaCl_2、$$Na_2SO_4$
B.HCl、$Ba(OH)_2、$$Na_2SO_4、$$BaCl_2$
C.H_2SO_4、$$Ba(OH)_2、$$Na_2SO_4、$$BaCl_2$$
$D.H_2SO_4、$NaOH、$BaCl_2、$$Na_2SO_4$
答案:
C
2. 下列叙述不符合实验事实的是( )
A.将$CO_2$气体通入$CaCl_2$溶液中,有白色沉淀产生
B.向$Fe(OH)_3$中加入足量的盐酸,溶液显黄色
C.在$Na_2CO_3、$$K_2SO_4、$$AgNO_3$三种溶液中分别滴加$BaCl_2$溶液,都有白色沉淀生成
D.久置于空气中的烧碱,加入足量稀盐酸会有气体放出
A.将$CO_2$气体通入$CaCl_2$溶液中,有白色沉淀产生
B.向$Fe(OH)_3$中加入足量的盐酸,溶液显黄色
C.在$Na_2CO_3、$$K_2SO_4、$$AgNO_3$三种溶液中分别滴加$BaCl_2$溶液,都有白色沉淀生成
D.久置于空气中的烧碱,加入足量稀盐酸会有气体放出
答案:
A
3. 实验室有一包白色固体由$K_2CO_3、$$K_2SO_4、$KCl、$CaCl_2$和$CuSO_4$中的一种或几种组成,实验记录如下:① 取该样品溶于水,得到无色溶液;② 取适量上述溶液加过量的$BaCl_2$溶液,出现白色沉淀,过滤;③ 向步骤②所得沉淀中加入过量的$HNO_3,$沉淀全部消失并产生气泡。下列分析中正确的是( )
A.原固体中一定含有$K_2CO_3,$可能含有$CuSO_4$和KCl
B.原固体中一定不含$K_2SO_4、$$CaCl_2$和$CuSO_4,$可能含有KCl
C.原固体中一定含有$K_2CO_3,$一定不含KCl、$CuSO_4$
D.若在步骤②所得滤液中滴入$AgNO_3$溶液,出现白色沉淀,则原固体中一定含有KCl
A.原固体中一定含有$K_2CO_3,$可能含有$CuSO_4$和KCl
B.原固体中一定不含$K_2SO_4、$$CaCl_2$和$CuSO_4,$可能含有KCl
C.原固体中一定含有$K_2CO_3,$一定不含KCl、$CuSO_4$
D.若在步骤②所得滤液中滴入$AgNO_3$溶液,出现白色沉淀,则原固体中一定含有KCl
答案:
解:①取样品溶于水得无色溶液,因CuSO₄溶液呈蓝色,故原固体一定不含CuSO₄;CaCl₂与K₂CO₃反应生成白色沉淀CaCO₃,二者不能共存,溶液无色则CaCl₂和K₂CO₃不能同时存在。
②加过量BaCl₂溶液有白色沉淀,沉淀可能为BaCO₃(来自K₂CO₃)或BaSO₄(来自K₂SO₄)。
③沉淀加过量HNO₃全部消失并产生气泡,BaSO₄不溶于HNO₃,BaCO₃溶于HNO₃且产生CO₂气泡,故沉淀为BaCO₃,原固体一定含K₂CO₃,一定不含K₂SO₄;由①知含K₂CO₃则一定不含CaCl₂。
综上:原固体一定含K₂CO₃,一定不含K₂SO₄、CaCl₂、CuSO₄,可能含KCl。
分析选项:
A. 含CuSO₄错误,A不符合。
B. 符合上述结论,B正确。
C. “一定不含KCl”错误,C不符合。
D. 步骤②加入BaCl₂引入Cl⁻,滴AgNO₃产生的AgCl沉淀不能证明原固体含KCl,D不符合。
结论:B
②加过量BaCl₂溶液有白色沉淀,沉淀可能为BaCO₃(来自K₂CO₃)或BaSO₄(来自K₂SO₄)。
③沉淀加过量HNO₃全部消失并产生气泡,BaSO₄不溶于HNO₃,BaCO₃溶于HNO₃且产生CO₂气泡,故沉淀为BaCO₃,原固体一定含K₂CO₃,一定不含K₂SO₄;由①知含K₂CO₃则一定不含CaCl₂。
综上:原固体一定含K₂CO₃,一定不含K₂SO₄、CaCl₂、CuSO₄,可能含KCl。
分析选项:
A. 含CuSO₄错误,A不符合。
B. 符合上述结论,B正确。
C. “一定不含KCl”错误,C不符合。
D. 步骤②加入BaCl₂引入Cl⁻,滴AgNO₃产生的AgCl沉淀不能证明原固体含KCl,D不符合。
结论:B
查看更多完整答案,请扫码查看


