2025年初高中衔接直通车化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年初高中衔接直通车化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
11. 在下图点滴板上有四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是(
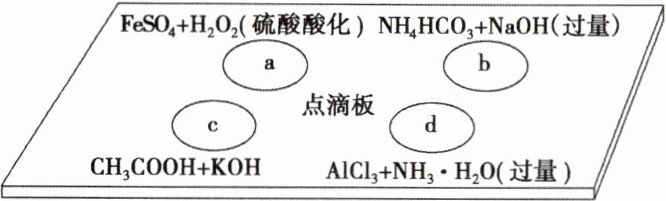
A.a反应:$Fe^2⁺ + 2H⁺ + H_2O_2 = Fe^3⁺ + 2H_2O$
B.b反应:$HCO_3⁻ + OH⁻ = CO_3^2⁻ + H_2O$
C.c反应:$H⁺ + OH⁻ = H_2O$
D.d反应:$Al^3⁺ + 3NH_3·H_2O = Al(OH)_3↓ + 3NH_4⁺$
D
)
A.a反应:$Fe^2⁺ + 2H⁺ + H_2O_2 = Fe^3⁺ + 2H_2O$
B.b反应:$HCO_3⁻ + OH⁻ = CO_3^2⁻ + H_2O$
C.c反应:$H⁺ + OH⁻ = H_2O$
D.d反应:$Al^3⁺ + 3NH_3·H_2O = Al(OH)_3↓ + 3NH_4⁺$
答案:
解析:选D。A.电荷不守恒;B.NaOH过量,$NH_{4}^{+}$与$OH^{-}$也反应,$NH_{4}^{+}+HCO_{3}^{-}+2OH^{-}=NH_{3}\cdot H_{2}O+CO_{3}^{2-}+H_{2}O$;C.$CH_{3}COOH$为弱酸,不能拆分,故选D。
12. 某无色溶液中只可能含有K⁺、Ag⁺、$Ba^2⁺、$$Cu^2⁺、$Cl⁻、$CO_3^2⁻、$$SO_4^2⁻$中的一种或几种,对其进行如下实验操作:
①取少量溶液,加入足量$BaCl_2$溶液,产生白色沉淀;
②向①所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
③将②所得混合物过滤,向滤液中加入$AgNO_3$溶液,有白色沉淀生成。
下列对该溶液的说法正确的是(
A.一定含有K⁺、$SO_4^2⁻、$$CO_3^2⁻$
B.可能含有Cl⁻、K⁺
C.一定含有$SO_4^2⁻、$$CO_3^2⁻、$Cl⁻
D.一定不含Ag⁺、$Cu^2⁺、$$SO_4^2⁻、$Cl⁻
①取少量溶液,加入足量$BaCl_2$溶液,产生白色沉淀;
②向①所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
③将②所得混合物过滤,向滤液中加入$AgNO_3$溶液,有白色沉淀生成。
下列对该溶液的说法正确的是(
A
)A.一定含有K⁺、$SO_4^2⁻、$$CO_3^2⁻$
B.可能含有Cl⁻、K⁺
C.一定含有$SO_4^2⁻、$$CO_3^2⁻、$Cl⁻
D.一定不含Ag⁺、$Cu^2⁺、$$SO_4^2⁻、$Cl⁻
答案:
解析:选A。某无色溶液中只可能含有$K^{+}$、$Ag^{+}$、$Ba^{2+}$、$Cu^{2+}$、$Cl^{-}$、$CO_{3}^{2-}$、$SO_{4}^{2-}$中的一种或几种,根据题目条件和实验现象判断如下:①溶液无色则无$Cu^{2+}$;②$Ag^{+}$与溶液中所有阴离子$Cl^{-}$、$CO_{3}^{2-}$、$SO_{4}^{2-}$按题目条件时都不能共存,所以溶液中无$Ag^{+}$;③取少量溶液,加入足量$BaCl_{2}$溶液,产生白色沉淀,由于无$Ag^{+}$,则能与$Ba^{2+}$产生沉淀的离子有$CO_{3}^{2-}$或$SO_{4}^{2-}$中的一种或两种都有;④向③所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成,由第③所得的沉淀可能是$BaCO_{3}$或$BaSO_{4}$,能溶于盐酸的是$BaCO_{3}$,不溶的是$BaSO_{4}$,根据沉淀部分溶解,说明是$BaCO_{3}$和$BaSO_{4}$都存在,则原溶液中一定有$CO_{3}^{2-}$和$SO_{4}^{2-}$,则与$CO_{3}^{2-}$和$SO_{4}^{2-}$不能共存的$Ba^{2+}$一定不存在,由于溶液中的阳离子$Ag^{+}$、$Cu^{2+}$、$Ba^{2+}$不存在,仅有的阳离子$K^{+}$一定存在;⑤将④所得混合物过滤,向滤液中加入$AgNO_{3}$溶液,有白色沉淀生成,说明滤液中存在$Cl^{-}$,但第③步加了盐酸提供了$Cl^{-}$,所以无法确定原溶液中是否存在$Cl^{-}$,通过以上判断得出原溶液中一定存在的是$K^{+}$、$CO_{3}^{2-}$、$SO_{4}^{2-}$;一定不存在的是$Ag^{+}$、$Cu^{2+}$、$Ba^{2+}$;可能存在的是$Cl^{-}$;根据分析解答。A.一定含有$K^{+}$、$SO_{4}^{2-}$、$CO_{3}^{2-}$,A正确;B.可能含有$Cl^{-}$,一定存在$K^{+}$,B错误;C.一定含有$SO_{4}^{2-}$、$CO_{3}^{2-}$,$Cl^{-}$可能存在,C错误;D.一定不含$Ag^{+}$、$Cu^{2+}$,$SO_{4}^{2-}$一定存在,$Cl^{-}$可能存在,D错误。
13. 下列指定溶液中不能大量共存的离子组是(
$A. 0.1mol·L⁻^1$的$AgNO_3$溶液:$NH_4⁺、$$Mg^2⁺、$Cl⁻、$SO_4^2⁻$
B. 含有大量$NO_3⁻$的溶液:H⁺、$Fe^3⁺、$Cl⁻、$SO_4^2⁻$
C. 澄清透明的溶液:$Fe^3⁺、$$Mg^2⁺、$Br⁻、Cl⁻
D. 无色溶液:H⁺、Cl⁻、$SO_4^2⁻、$K⁺
A
)$A. 0.1mol·L⁻^1$的$AgNO_3$溶液:$NH_4⁺、$$Mg^2⁺、$Cl⁻、$SO_4^2⁻$
B. 含有大量$NO_3⁻$的溶液:H⁺、$Fe^3⁺、$Cl⁻、$SO_4^2⁻$
C. 澄清透明的溶液:$Fe^3⁺、$$Mg^2⁺、$Br⁻、Cl⁻
D. 无色溶液:H⁺、Cl⁻、$SO_4^2⁻、$K⁺
答案:
解析:选A。$Cl^{-}$、$SO_{4}^{2-}$和银离子会生成沉淀而不能大量共存,A符合题意;四种离子之间不反应,可以大量共存,B不符合题意;四种离子相互之间不反应,不产生沉淀,可以在澄清透明的溶液中大量共存,C不符合题意;四种离子相互之间不反应,且无色,可以大量共存,D不符合题意。
14. 离子方程式$CO_3^2⁻ + 2H⁺ = CO_2↑ + H_2O$表示(
A.碳酸盐与盐酸之间的反应
B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与强酸之间的反应
D.可溶性碳酸盐与一切酸之间的反应
C
)A.碳酸盐与盐酸之间的反应
B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与强酸之间的反应
D.可溶性碳酸盐与一切酸之间的反应
答案:
解析:选C。离子方程式$CO_{3}^{2-}+2H^{+}=CO_{2}\uparrow +H_{2}O$表示可溶性的碳酸盐与强酸之间的复分解反应。
15. 已知某无色溶液中可能含有$SO_4^2⁻、$Na⁺、$CO_3^2⁻、$$HCO_3⁻、$H⁺、$NO_3⁻、$$Cu^2⁺、$Cl⁻等离子中的若干种。对该溶液做如下实验:
①取少量溶液,用pH试纸检验,得pH = 1。
②重新取原溶液,用稀盐酸和$BaCl_2$检验该溶液,有白色沉淀生成。
③将②所得的浊液静置,取上层清液,往清液中加入少量的$AgNO_3$溶液和稀硝酸,结果又有白色沉淀生成。
(1)可得出结论:原溶液中一定有
(2)步骤②的离子反应方程式为
①取少量溶液,用pH试纸检验,得pH = 1。
②重新取原溶液,用稀盐酸和$BaCl_2$检验该溶液,有白色沉淀生成。
③将②所得的浊液静置,取上层清液,往清液中加入少量的$AgNO_3$溶液和稀硝酸,结果又有白色沉淀生成。
(1)可得出结论:原溶液中一定有
$H^{+}$、$SO_{4}^{2-}$
,一定没有$CO_{3}^{2-}$、$HCO_{3}^{-}$、$Cu^{2+}$
,可能有$Na^{+}$、$NO_{3}^{-}$、$Cl^{-}$
。(2)步骤②的离子反应方程式为
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}\downarrow$
;步骤③的离子反应方程式为$Ag^{+} + Cl^{-} = AgCl\downarrow$
。
答案:
(1) $H^{+}$、$SO_{4}^{2-}$;$CO_{3}^{2-}$、$HCO_{3}^{-}$、$Cu^{2+}$;$Na^{+}$、$NO_{3}^{-}$、$Cl^{-}$
(2) $Ba^{2+} + SO_{4}^{2-} = BaSO_{4}\downarrow$;$Ag^{+} + Cl^{-} = AgCl\downarrow$
(1) $H^{+}$、$SO_{4}^{2-}$;$CO_{3}^{2-}$、$HCO_{3}^{-}$、$Cu^{2+}$;$Na^{+}$、$NO_{3}^{-}$、$Cl^{-}$
(2) $Ba^{2+} + SO_{4}^{2-} = BaSO_{4}\downarrow$;$Ag^{+} + Cl^{-} = AgCl\downarrow$
16. 如图以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同。结合此图回答下列问题。

(1)稀盐酸中阳离子的符号是
(2)反应①中石蕊溶液变为
(3)反应⑤的离子方程式为
(4)图中只生成盐和水的反应有
(5)若X溶液既能跟稀盐酸反应,又能跟$Ca(OH)_2$反应,则X可能是$BaCl_2、$$CuSO_4、$$Na_2CO_3$中的

(1)稀盐酸中阳离子的符号是
H⁺
。(2)反应①中石蕊溶液变为
红
色。(3)反应⑤的离子方程式为
Al₂O₃+6H⁺=2Al³⁺+3H₂O
。(4)图中只生成盐和水的反应有
③⑤
(填序号)。(5)若X溶液既能跟稀盐酸反应,又能跟$Ca(OH)_2$反应,则X可能是$BaCl_2、$$CuSO_4、$$Na_2CO_3$中的
Na₂CO₃
。
答案:
(1)$H^{+}$
(2)红
(3)$Al_{2}O_{3}+6H^{+}=2Al^{3+}+3H_{2}O$
(4)③⑤
(5)$Na_{2}CO_{3}$
(1)$H^{+}$
(2)红
(3)$Al_{2}O_{3}+6H^{+}=2Al^{3+}+3H_{2}O$
(4)③⑤
(5)$Na_{2}CO_{3}$
查看更多完整答案,请扫码查看


