2025年赢在假期期末加寒假九年级化学人教版合肥工业大学出版社
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在假期期末加寒假九年级化学人教版合肥工业大学出版社 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
9. 草酸亚铁(FeC₂O₄)常用于生产锂电池,它在不同温度下分解能得到不同的铁的氧化物,同时放出气体,43.2 g FeC₂O₄受热分解所得固体质量随温度变化如图所示,下列说法正确的是 ( )
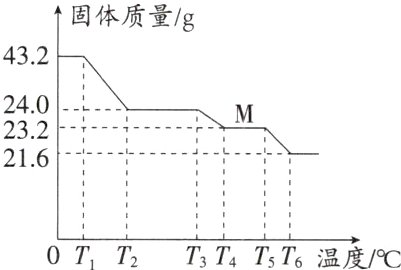
A. FeC₂O₄由铁原子、碳原子、氧原子直接构成
B. 根据数据可推出固体M的化学式为Fe₃O₄
C. T₄℃时,固体M开始分解
D. 固体质量由43.2 g变为24.0 g时的化学方程式为FeC₂O₄ $\xlongequal{\triangle}$ FeCO₃ + CO↑

A. FeC₂O₄由铁原子、碳原子、氧原子直接构成
B. 根据数据可推出固体M的化学式为Fe₃O₄
C. T₄℃时,固体M开始分解
D. 固体质量由43.2 g变为24.0 g时的化学方程式为FeC₂O₄ $\xlongequal{\triangle}$ FeCO₃ + CO↑
答案:
B解析:A.根据$FeC_{2}O_{4}$化学式可知,$FeC_{2}O_{4}$由亚铁离子和草酸根离子构成,错误;B.草酸亚铁$(FeC_{2}O_{4})$在不同温度下分解能得到不同的铁的氧化物,同时放出气体,由图可知,生成M的质量为23.2g,根据质量守恒定律,化学反应前后元素的种类和质量不变,则M中铁元素的质量与草酸亚铁中铁元素的质量相同,则铁元素的质量为:43.2g ×$\frac{56}{56+12×2+16×4}$×100%=16.8g,则M中氧元素的质量=23.2g−16.8g=6.4g,设M的化学式为:$Fe_{a}O_{b}$,则56a:16b=16.8g:6.4g,a:b=3:4,故M的化学式为$Fe_{3}O_{4}$,正确;C.根据图示可知,$T_{5}^{\circ}C$时,固体M开始分解,错误;D.固体质量由43.2g变为24.0g时,若按$FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3} + CO\uparrow$反应进行,设反应过程中生成的$FeCO_{3}$质量为x。
$FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3} + CO\uparrow$
144 116
43.2g x
$\frac{144}{116} = \frac{43.2 g}{x}$
x=34.8g
根据图示可知,若按$FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3} + CO\uparrow$反应进行,产生$FeCO_{3}$的质量=34.8g ≠24.0g,错误。故选B。
$FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3} + CO\uparrow$
144 116
43.2g x
$\frac{144}{116} = \frac{43.2 g}{x}$
x=34.8g
根据图示可知,若按$FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3} + CO\uparrow$反应进行,产生$FeCO_{3}$的质量=34.8g ≠24.0g,错误。故选B。
10. 在“质量守恒定律”的课堂学习中,同学们设计了如下图所示的实验来验证质量守恒定律。回答下列问题:

【实验验证】
(1)A实验反应前后天平左盘上的仪器与药品的总质量________(填“相等”或“不相等”)。
(2)B实验中天平指针会向________(填“左”或“右”)偏转,原因是________________________。
【微观解释】
(3)由质量守恒定律可知,化学反应前后一定不变的是________(填序号)。
①原子种类 ②原子数目 ③原子质量 ④分子种类
【综合应用】
(4)24 g镁在氧气中完全燃烧后,生成氧化镁的质量________(填“大于”“小于”或“等于”)24 g。
(5)植物的光合作用可表示为:二氧化碳 + 水 $\xrightarrow{光照}$ 淀粉 + 氧气,可推测淀粉中一定含有________元素。

【实验验证】
(1)A实验反应前后天平左盘上的仪器与药品的总质量________(填“相等”或“不相等”)。
(2)B实验中天平指针会向________(填“左”或“右”)偏转,原因是________________________。
【微观解释】
(3)由质量守恒定律可知,化学反应前后一定不变的是________(填序号)。
①原子种类 ②原子数目 ③原子质量 ④分子种类
【综合应用】
(4)24 g镁在氧气中完全燃烧后,生成氧化镁的质量________(填“大于”“小于”或“等于”)24 g。
(5)植物的光合作用可表示为:二氧化碳 + 水 $\xrightarrow{光照}$ 淀粉 + 氧气,可推测淀粉中一定含有________元素。
答案:
(1)相等
(2)右 蜡烛燃烧生成的二氧化碳和水散逸到了空气中
(3)①②③
(4)大于
(5)碳、氢
(1)相等
(2)右 蜡烛燃烧生成的二氧化碳和水散逸到了空气中
(3)①②③
(4)大于
(5)碳、氢
11. “化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(KO₂),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为:4KO₂ + 2H₂O == 4KOH + 3O₂↑。为测定某制氧剂样品中超氧化钾的含量,取20 g样品加入到盛有50 g足量水的烧杯中,充分反应后(杂质不与水反应),烧杯中物质总质量为65.2 g。计算:
(1)产生氧气质量为________g。
(2)样品中超氧化钾的质量分数。
(1)产生氧气质量为________g。
(2)样品中超氧化钾的质量分数。
答案:
(1)4.8
(2)解:设样品中超氧化钾的质量为x,
$4KO_{2} + 2H_{2}O = 4KOH + 3O_{2}\uparrow$
284 96
x 4.8g
$\frac{284}{96} = \frac{x}{4.8 g}$
x=14.2g
则样品中超氧化钾的质量分数为$\frac{14.2 g}{20 g}\times100\% = 71\%$。
答:样品中超氧化钾的质量分数为71%。
(1)4.8
(2)解:设样品中超氧化钾的质量为x,
$4KO_{2} + 2H_{2}O = 4KOH + 3O_{2}\uparrow$
284 96
x 4.8g
$\frac{284}{96} = \frac{x}{4.8 g}$
x=14.2g
则样品中超氧化钾的质量分数为$\frac{14.2 g}{20 g}\times100\% = 71\%$。
答:样品中超氧化钾的质量分数为71%。
查看更多完整答案,请扫码查看


