【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑ B. 2 NaHCO3 ![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C. Na2O+H2O=2NaOH D. Zn+H2SO4=ZnSO4 +H2↑
参考答案:
【答案】D
【解析】
若反应中有元素的化合价的变化,就是氧化还原反应,没有元素化合价变化的反应是非氧化还原反应,据此分析判断。
A.该反应是复分解反应,没有元素化合价的变化,不属于氧化还原反应,A错误;
B.该反应是分解反应,在反应过程中元素的化合价没有变化,不属于氧化还原反应,B错误;
C.该反应是化合反应,反应过程中元素的化合价没有变化,不属于氧化还原反应,C错误;
D.该反应是置换反应,反应过程中有元素的化合价的变化,属于氧化还原反应,D正确;
故合理选项是D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下向1mol/LCH3COOH溶液中逐滴加入1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是
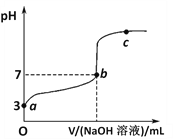
A. a与c之间的溶液中b点水的电离程度最大
B. 溶液中存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-)的点一定在a与b之间且靠近b
C. b点时,NaOH溶液与醋酸不是恰好反应,V(NaOH溶液)<V(CH3COOH溶液)
D. a、b、c点表示的溶液中c(CH3COO-)/[ c(CH3COOH)·c(OH-)]均相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】室温下,浓度均为0.1mol·L-1、体积均为Vo的HA、HB溶液,分别加水稀释至V,pH随
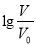 的变化如图所示,下列说法正确的是
的变化如图所示,下列说法正确的是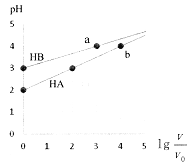
A. HA为强酸,HB为弱酸 B. 水的电离程度a点大于b点
C. 当pH=2时,HA溶液中
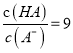 D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-)
D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-) -
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关说法正确的是
A. 1mol/L的Na2CO3溶液中含有钠离子约为2×6.02×1023
B. 含氧原子数均为NA的O2和O3的物质的量之比为3:2
C. 每1mol任何物质均含有约为6.02×1023个原子
D. 含氢原子数目相同的NH3和CH4在同温同压下的体积之比为3:4
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为阳离子交换膜法电解精制的饱和食盐水原理示意图。其中阳离子交换膜仅允许Na+通过。下列说法错误的是
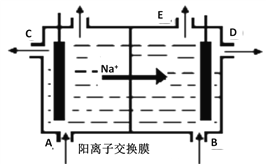
A. 从A口加入精制的浓食盐水
B. 从E口放出的气体是H2
C. D口导出的是含少量氯化钠的NaOH溶液
D. B口NaOH的浓度小于D口
-
科目: 来源: 题型:
查看答案和解析>>【题目】某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2 + O2
 2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:
2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:
(1)加催化剂的图象是___________。
(2)升高温度的图象是___________。
(3)增大容器体积的图象是_______。
(4)增大O2的浓度的图象是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据所学知识填写下列空白。
(1)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成1mol NH3的反应热ΔH =__________________。
(2)氢气的燃烧热为286kJ/mol。写出表示氢气燃烧热的热化学方程式____________________________________________。
(3)某温度下纯水中的c(H+) = 1×10-6.5mol/L。若温度不变,滴入稀硫酸使c(H+)= 5×10-5mol/L,则由水电离出的c(H+) =__________mol/L。
(4)已知在第(3)问条件下,盐酸的pH=a,氢氧化钡的pH=b。若酸碱按体积比1:10混合后溶液显中性,则a+b=_________。
(5)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-, HB-
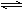 H++B2-。
H++B2-。已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中c(H+)小于0.11 mol/L的原因是____________________________________。
相关试题

