【题目】室温下,浓度均为0.1mol·L-1、体积均为Vo的HA、HB溶液,分别加水稀释至V,pH随![]() 的变化如图所示,下列说法正确的是
的变化如图所示,下列说法正确的是
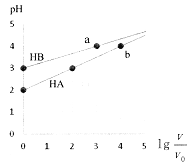
A. HA为强酸,HB为弱酸 B. 水的电离程度a点大于b点
C. 当pH=2时,HA溶液中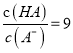 D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-)
D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-)
参考答案:
【答案】C
【解析】A.由图示可知,室温下浓度相等的HA和HB,HA的溶液pH小,即HA的酯性比HB强,但0.1mol/LHA的pH=2,说明HA也为弱酸,故A错误;B.HA和HB的水溶液中水的电离均受到抑制,a点和b点溶液的pH相等,说明水的电离程度相同,故B错误;C.0.1mol/LHA溶液中pH=2,则此时c(H+)=c(A-)=0.01mol/L,c(HA)=0.1mol/L-0.01mol/L=0.09mol/L, 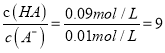 ,故C正确; D.等浓度等体积的HB与Na0H溶液充分反应后得到NaB溶液,因B-的水解溶液显碱性,离子浓度关系大小为: c(Na+)>c(B-)>c(OH-)>c(H+),故D错误;答案为C。
,故C正确; D.等浓度等体积的HB与Na0H溶液充分反应后得到NaB溶液,因B-的水解溶液显碱性,离子浓度关系大小为: c(Na+)>c(B-)>c(OH-)>c(H+),故D错误;答案为C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关除杂方法正确的是
A. 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤
B. 除去FeCl3中少量CuCl2:加入足量铁粉,过滤
C. 除去NaHCO3溶液中的Na2CO3:通入过量CO2充分反应
D. 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤
-
科目: 来源: 题型:
查看答案和解析>>【题目】X、Y、Z、R、W是原子序数递增的五种短周期主族元素,周期数之和为11,其中Y元素最高化合价与最低化合价代数和为2, Z和R可形成R2Z和R2Z2型化合物,R是五种元素中原子半径最大的,Z和W是同族元素,下列说法错误的是
A. 简单离子半径人小顺序为:W>Z>R
B. X2Z2的电子式为:

C. X2Z的沸点比X2W的沸点高
D. Y元素最高价氧化物的水化物浓溶液可以用铝制容器盛装
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】配制一定物质的量浓度的溶液时,下列操作会使所配得的溶液物质的量浓度偏高的是 ( )
A. 省去洗涤烧杯的步骤
B. 定容时俯视刻度
C. 定容时仰视刻度
D. 定容、摇匀、静置后发现凹液面低于刻度线又加水至刻度
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化氢分子中含有过氧键(﹣O﹣O﹣).有机化合物A的相对分子质量为120.经分析,其中氧的质量分数为0.5334,其余为碳和氢,则A分子中过氧键数最多为( )
A.1
B.2
C.3
D.4 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述中,正确的是 ( )
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等物质的量的CO与CO2中所含碳原子数之比为2︰7
D. 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L
相关试题

