【题目】某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2 + O2 ![]() 2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:
2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:

(1)加催化剂的图象是___________。
(2)升高温度的图象是___________。
(3)增大容器体积的图象是_______。
(4)增大O2的浓度的图象是______。
参考答案:
【答案】 C A D B
【解析】(1)加入催化剂,化学反应速率加快,化学平衡不移动,故图象选C;
(2)升温,正逆反应速率都增大,平衡逆向移动,逆反应速率增大的更大,故图象选A;
(3)增大反应容器体积,反应物和生成物的浓度都减小,平衡逆向移动,逆反应减少的幅度小,故图象选D;
(4)增大O2的浓度,化学反应速率加快,化学平衡向着正反应方向进行,而增大氧气的瞬间生成物的浓度未变,所以V逆不变,故图象选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关说法正确的是
A. 1mol/L的Na2CO3溶液中含有钠离子约为2×6.02×1023
B. 含氧原子数均为NA的O2和O3的物质的量之比为3:2
C. 每1mol任何物质均含有约为6.02×1023个原子
D. 含氢原子数目相同的NH3和CH4在同温同压下的体积之比为3:4
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑ B. 2 NaHCO3
 Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑C. Na2O+H2O=2NaOH D. Zn+H2SO4=ZnSO4 +H2↑
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为阳离子交换膜法电解精制的饱和食盐水原理示意图。其中阳离子交换膜仅允许Na+通过。下列说法错误的是
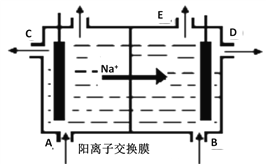
A. 从A口加入精制的浓食盐水
B. 从E口放出的气体是H2
C. D口导出的是含少量氯化钠的NaOH溶液
D. B口NaOH的浓度小于D口
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据所学知识填写下列空白。
(1)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成1mol NH3的反应热ΔH =__________________。
(2)氢气的燃烧热为286kJ/mol。写出表示氢气燃烧热的热化学方程式____________________________________________。
(3)某温度下纯水中的c(H+) = 1×10-6.5mol/L。若温度不变,滴入稀硫酸使c(H+)= 5×10-5mol/L,则由水电离出的c(H+) =__________mol/L。
(4)已知在第(3)问条件下,盐酸的pH=a,氢氧化钡的pH=b。若酸碱按体积比1:10混合后溶液显中性,则a+b=_________。
(5)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-, HB-
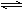 H++B2-。
H++B2-。已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中c(H+)小于0.11 mol/L的原因是____________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验小组同学做中和滴定和中和热的测定两个实验。
Ⅰ.下图是该小组同学用0.5000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和第1次滴定前、后盛放盐酸的滴定管中液面的位置。请回答下列问题。

(1)仪器A的名称是_______________。
(2)第1次滴定消耗标准液_________mL 。
(3)已知每次滴定操作所取待测NaOH溶液的体积均为20.00mL。第2、3、4次滴定数据如下表所示。通过计算得待测NaOH溶液的平均浓度是___________mol/L。(保留四位有效数字)
实验
编号
待测NaOH溶液的体积(mL)
滴定前盐酸的
体积读数(mL)
滴定后盐酸的
体积读数(mL)
2
20.00
1.20
21.20
3
20.00
2.24
22.26
4
20.00
1.50
21.48
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.向锥形瓶里注入20.00 mL待测NaOH溶液,并滴入2-3滴酚酞;
B.用标准溶液润洗酸式滴定管2-3次;
C.固定好装标准溶液的酸式滴定管,调节滴定管尖嘴使之充满溶液,管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2-3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准HCl溶液滴定至终点并记下滴定管液面刻度。
合理的操作顺序是(用序号字母填写)______________________________。
(5)如何判断到达滴定终点?_________________________________________。
(6)如果上述B步骤省略,对测定结果的影响是_________;标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是______(填“无影响”、“偏高”、“偏低”)。
Ⅱ.现用上述盐酸和已测出浓度的NaOH溶液,设计如下装置测定中和热。
将50mL盐酸与50mL NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(7)从图示看此装置存在错误,请指出_________________。
(8)当室内温度低于10℃时,对实验数据影响很大,实验测得的中和热数值偏小。其原因是___________________。
(9)如果实验测得起始温度为t1℃,反应后的最高温度为t2℃,则中和热的表达式为ΔH =___________。(中和后溶液的比热容c=4.18J/(g.℃))
(10)本次实验室内温度正常,操作无误,但是数据偏低,其原因是_________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的量浓度相等的NaCl、FeCl2、FeCl3三种溶液分别与等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、FeCl2 、FeCl3三种溶液的体积之比是
A. 1:2:3 B. 3:2:1 C. 6::3:2 D. 1:1:1
相关试题

