【题目】常温下向1mol/LCH3COOH溶液中逐滴加入1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是
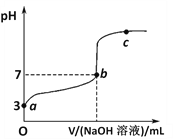
A. a与c之间的溶液中b点水的电离程度最大
B. 溶液中存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-)的点一定在a与b之间且靠近b
C. b点时,NaOH溶液与醋酸不是恰好反应,V(NaOH溶液)<V(CH3COOH溶液)
D. a、b、c点表示的溶液中c(CH3COO-)/[ c(CH3COOH)·c(OH-)]均相等
参考答案:
【答案】A
【解析】A. 根据图像,a点为醋酸溶液,水的电离受到抑制,逐滴加入氢氧化钠,溶液中的氢离子浓度逐渐减小,水的电离程度逐渐增大,当恰好生成醋酸钠时,水的电离受到的促进程度最大,此时溶液显弱碱性,不是b点,故A错误;B. 从a点开始加入氢氧化钠溶液,溶液的酸性逐渐减弱,开始阶段存在c(CH3COO-)> c(H+)>c(Na+)> c(OH-),当氢氧化钠继续加入,逐渐过渡到c(CH3COO-)> c(H+)=c(Na+)> c(OH-),然后c(CH3COO-)>c(Na+)>c(H+)>c(OH-),再出现c(CH3COO-)=c(Na+)>c(H+)=c(OH-),对应于b点,因此该点在a与b之间且靠近b,故B正确;C. NaOH溶液与醋酸恰好反应,生成醋酸钠,溶液显碱性,因此b点时,NaOH溶液与醋酸不是恰好反应,且V(NaOH溶液)<V(CH3COOH溶液),故C正确;D. ![]() =
=![]() =
=![]() ,温度不变,K不变,因此a、b、c点表示的溶液中都存在
,温度不变,K不变,因此a、b、c点表示的溶液中都存在![]() 且相等,故D正确;故选A。
且相等,故D正确;故选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
-
科目: 来源: 题型:
查看答案和解析>>【题目】同温同压下,相同体积的两种气体A、B的质量比为22:17,若A气体为CO2,则B气体可能是
A. NH3 B. H2S C. SO2 D. O2
-
科目: 来源: 题型:
查看答案和解析>>【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是( )
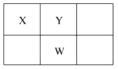
A. Z的最高价氧化物对应的水化物不可能显弱碱性
B. Y的简单阴离子比W的简单阴离子的还原性弱
C. X、W、Q的氢化物均可在Y的单质中燃烧
D. Q的氢化物的水溶液能与W的盐反应得到W的氢化物,说明非金属性Q>W
-
科目: 来源: 题型:
查看答案和解析>>【题目】室温下,浓度均为0.1mol·L-1、体积均为Vo的HA、HB溶液,分别加水稀释至V,pH随
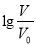 的变化如图所示,下列说法正确的是
的变化如图所示,下列说法正确的是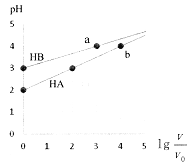
A. HA为强酸,HB为弱酸 B. 水的电离程度a点大于b点
C. 当pH=2时,HA溶液中
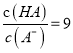 D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-)
D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-) -
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关说法正确的是
A. 1mol/L的Na2CO3溶液中含有钠离子约为2×6.02×1023
B. 含氧原子数均为NA的O2和O3的物质的量之比为3:2
C. 每1mol任何物质均含有约为6.02×1023个原子
D. 含氢原子数目相同的NH3和CH4在同温同压下的体积之比为3:4
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑ B. 2 NaHCO3
 Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑C. Na2O+H2O=2NaOH D. Zn+H2SO4=ZnSO4 +H2↑
相关试题

