【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。

(2)根据上述实验判断原溶液中肯定存在的离子是__________,肯定不存在的离子是_________。
(3)写出与②和③两个实验有关的离子方程式:
②______________________________,③_______________________________。
参考答案:
【答案】BD NO3-、Al3+、SO42- Fe3+、Ba2+、HCO3- 3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O Al3++3NH3·H2O====Al(OH)3↓+3NH4+
【解析】
(1)用试纸检验溶液的酸碱性时,应用玻璃棒蘸取少量溶液(或用胶头滴管滴加)滴在放在玻璃片的试纸上检验;
(2)①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-,溶液无色,则不存在Fe3+;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不会含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡;
根据以上分析解答。
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,据此写出该反应的离子方程式;
③铝离子和一水合氨反应生成氢氧化铝白色沉淀和铵根离子,据此写出该反应的离子方程式。
(1)用试纸检验溶液的酸碱性时,应用玻璃棒蘸取少量溶液(或用胶头滴管滴加)滴在放在玻璃片的试纸上检验;故答案为:BD;
(2)①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-,溶液无色,则不存在Fe3+;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不会含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡,
结合以上分析可知,原溶液中肯定存在的离子是NO3-、Al3+、SO42-;肯定不存在的离子是Fe3+、Ba2+、HCO3-;
综上所述,本题答案是:NO3-、Al3+、SO42-;Fe3+、Ba2+、HCO3-。
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
综上所述,本题答案是: 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
③Al(OH)3不溶于弱碱,则在含Al3+溶液中加入足量的氨水只生成Al(OH)3,反应的离子方程式为Al3++3NH3H2O═Al(OH)3↓+3NH4+;
综上所述,本题答案是: Al3++3NH3H2O═Al(OH)3↓+3NH4+。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO
 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是A. 装置B、E中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置D中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先关闭分液漏斗的活塞,再熄灭酒精灯
D. 装置F收集的气体中可能含有NO
-
科目: 来源: 题型:
查看答案和解析>>【题目】对可逆反应4NH3(g)+ 5O2(g)
 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)
 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )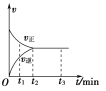
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=
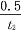 mol·L-1·min-1
mol·L-1·min-1D. 若t3 min时升高温度,则反应速率不变
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有五种物质①二氧化硅 ②铁 ③碳酸钡 ④碳酸钾 ⑤氧化钙,其中不溶于水,但溶于稀盐酸并放出无色气体的是( )
A.①⑤B.③⑤C.②③D.②④
-
科目: 来源: 题型:
查看答案和解析>>【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: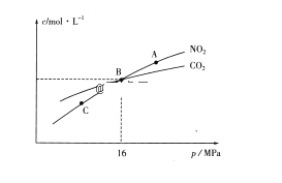
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
-
科目: 来源: 题型:
查看答案和解析>>【题目】反应A(g)+3B(g)
 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )A. v(C)=0.8mol·(L·min)-1B. v(B)=0.9mol·(L·min)-1
C. v(A)=0.3mol·(L·min)-1D. v(D)=0.6mol·(L·min)-1
相关试题

