【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
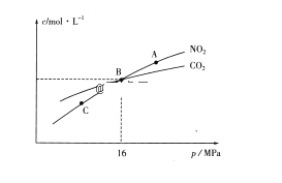
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
参考答案:
【答案】2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),H=-544 KJ/mol 放热 0.01mol/(L·min) = C
【解析】
(1)根据焓变=反应物总键能-生成物总键能计算1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的焓变;
(2)①比较甲、丙的图表数据,丙的反应速率大于甲,可知丙的温度大于400℃,平衡时丙的NO浓度大于甲,所以升高温度平衡逆向移动;
②根据v=c/t计算反应速率;
(3)①A、C两点温度相同,所以平衡常数相等;
②增大压强平衡逆向移动;
③根据平衡常数表达式计算B点时该反应的压强平衡常数。
(1)根据焓变=反应物总键能-生成物总键能,1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的焓变=193KJ/mol+391 KJ/mol×4+497 KJ/mol-946 KJ/mol-463 KJ/mol×4=-544 KJ/mol,所以1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式是:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),H=-544 KJ/mol;
综上所述,本题答案是:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),H=-544 KJ/mol。
(2)①比较甲、丙的图表数据,丙的反应速率大于甲,可知丙的温度大于400℃,平衡时丙的NO浓度大于甲,所以升高温度平衡逆向移动,所以正反应放热;
综上所述,本题答案是:放热。
② 2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始量 2 0 0
变化量 1.2 0.6 0.6
平衡量 0.8 0.6 0.6
容器的体积为1L,所以甲中反应的平衡常数为=c(N2)×c(CO2)/ c2(NO)=0.6×0.6/0.8=4.5;甲乙温度相同,所以平衡常数相同,设乙装置NO的浓度变化量为xmol/L,
2NO(g)+C(s)![]() N2(g)+CO2(g),
N2(g)+CO2(g),
起始量 1 0 0
变化量 x 0.5x 0.5x
平衡量 1-x 0.5x 0.5x
所以:0.5x×0.5x/(1-x)2=4.5, x=0.6,根据v=c/t,v(NO)=0.6/60=0.01mol/(L·min);
综上所述,本题答案是:0.01mol/(L·min)。
(3)①A、C两点温度相同,所以平衡常数相等,故Kc(A)=Kc(C);综上所述,本题答案是:=。
②增大压强平衡逆向移动,NO2的转化率最高的是C;综上所述,本题答案是:C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)
 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )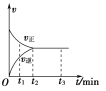
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=
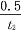 mol·L-1·min-1
mol·L-1·min-1D. 若t3 min时升高温度,则反应速率不变
-
科目: 来源: 题型:
查看答案和解析>>【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。

(2)根据上述实验判断原溶液中肯定存在的离子是__________,肯定不存在的离子是_________。
(3)写出与②和③两个实验有关的离子方程式:
②______________________________,③_______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有五种物质①二氧化硅 ②铁 ③碳酸钡 ④碳酸钾 ⑤氧化钙,其中不溶于水,但溶于稀盐酸并放出无色气体的是( )
A.①⑤B.③⑤C.②③D.②④
-
科目: 来源: 题型:
查看答案和解析>>【题目】反应A(g)+3B(g)
 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )A. v(C)=0.8mol·(L·min)-1B. v(B)=0.9mol·(L·min)-1
C. v(A)=0.3mol·(L·min)-1D. v(D)=0.6mol·(L·min)-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】取50mL0.3mol/L的硫酸注入250mL容量瓶中,加水稀释至刻度线,则该溶液中的H+的物质的量浓度为
A. 0.06mol/L B. 0.12 mol/L C. 0.24mol/L D. 0.03mol/L
-
科目: 来源: 题型:
查看答案和解析>>【题目】可逆反应N2+3H2
 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是A. 3v正(N2)=v正(H2)B. 2v正(N2)=v逆(NH3)
C. v正(N2)=3v逆(H2)D. 2v正(H2)=3v逆(NH3)
相关试题

