【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
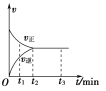
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. 若t3 min时升高温度,则反应速率不变
参考答案:
【答案】C
【解析】
A、t1 min时,正、逆反应都发生,只是正反应速率大于逆反应速率,反应正向进行,选项A错误;B、由图可知,t2~t3 min内,该反应已达平衡状态,X的消耗速率等于其生成速率,v(X)正不为0,反应并没有停止,选项B错误;C、由反应方程式可知,生成1.5 mol Y时消耗1 mol X,则0~t2 min内v(X)=![]() mol·L-1·min-1=
mol·L-1·min-1=![]() mol·L-1·min-1,选项C正确;D、升温能加快化学反应速率,选项D错误。答案选C。
mol·L-1·min-1,选项C正确;D、升温能加快化学反应速率,选项D错误。答案选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,
 化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是
化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是共价键
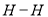
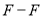
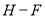
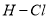
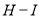
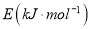
436
157
568
432
298
A.
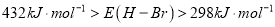
B. 表中最稳定的共价键是H-F键
C.
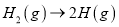

D.
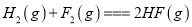
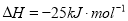
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3-
B.
 =1x10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
=1x10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-C. 与Al反应能放出H2的溶液中:Fe3+、K+、NO3- 、SO42-
D. 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42-、
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一密闭容器中,充入一定量的反应物A,反应
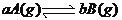 达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则
达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则A. 平衡向正反应方向移动了 B. 物质A的转化率降低
C. 物质B的质量增加 D.
-
科目: 来源: 题型:
查看答案和解析>>【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量;1 mol CH4 完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写中正确的是( )
A. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=890.3 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ·mol-1
C. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ
D. 2H2(g)+O2(g)===2H2O(l)ΔH=-517.6 kJ
-
科目: 来源: 题型:
查看答案和解析>>【题目】对常温下
 的
的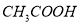 溶液,下列叙述不正确的是
溶液,下列叙述不正确的是A.
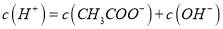
B. 加入少量
 固体后,
固体后, 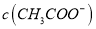 降低
降低C. 该溶液中由
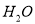 电离出的
电离出的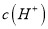 是
是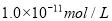
D. 与等体积
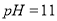 的
的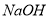 溶液混合后所得溶液显酸性
溶液混合后所得溶液显酸性 -
科目: 来源: 题型:
查看答案和解析>>【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g)
 2NH3(g) H<0合成氨,其基本合成过程如下:
2NH3(g) H<0合成氨,其基本合成过程如下: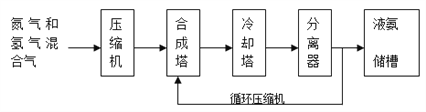
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(N2)=___________mol·L-1·min-1。
②相对a而言,b可能改变的条件是______________________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1~t2时刻c(H2)的变化曲线________。
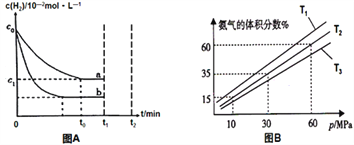
(2)某小组往一恒温恒压容器充入9 mol N2和23 mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
① 此时N2的平衡分压为__________MPa,H2的平衡分压为___________MPa。(分压=总压×物质的量分数)
② 列式计算此时的平衡常数Kp=____。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是_____________________。
相关试题

