第20页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
1. 从空气中分离出氧气。
(1) 工业制法。
①原理:利用液态氧和液态氮的
②过程:空气$\xrightarrow[加压]{低温}$液态空气$\xrightarrow[ - 196{\hspace{0pt}}^{\circ }C ]{升温}$氮气(先分离出来)、主要是液氧(贮存在淡蓝色的钢瓶中)
(2) 制氧新方法:在一定压力下,让空气通过
(1) 工业制法。
①原理:利用液态氧和液态氮的
沸点
不同,采用分离液态空气法获得氧气。此过程发生物理
变化。②过程:空气$\xrightarrow[加压]{低温}$液态空气$\xrightarrow[ - 196{\hspace{0pt}}^{\circ }C ]{升温}$氮气(先分离出来)、主要是液氧(贮存在淡蓝色的钢瓶中)
(2) 制氧新方法:在一定压力下,让空气通过
特殊薄膜
或多孔性材料(如分子筛),将氧气和氮气分离,从而得到高纯度的氧气。
答案:
1.(1)①沸点 物理 (2)特殊薄膜
2. 利用化学反应制备氧气。
(1) 反应原理。(用反应的符号表达式表示)
加热高锰酸钾:
双氧水分解:
氯酸钾和二氧化锰共热:
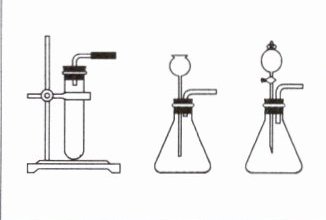
(2) 发生装置。
发生装置选择的依据:
|药品|①高锰酸钾;②氯酸钾和二氧化锰|过氧化氢溶液和二氧化锰|
|--|--|--|
|反应物状态、反应条件|固体、加热|固体和液体、不需要加热|
|发生装置|||
(3) 收集装置。
|收集方法|向上排空气法|排水法|
|--|--|--|
|依据|氧气的密度比空气的
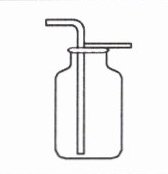
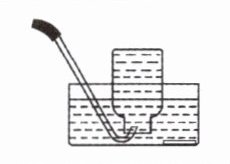
|收集装置|||
(4) 实验步骤:检查
(5) 氧气的检验:将带火星的木条
(6) 氧气的验满:用排水法收集时,当集气瓶口有

(1) 反应原理。(用反应的符号表达式表示)
加热高锰酸钾:
${KMnO_{4}->[加热]K_{2}MnO_{4} + MnO_{2} + O_{2}}$
。双氧水分解:
${H_{2}O_{2}->[MnO_{2}]H_{2}O + O_{2}}$
。氯酸钾和二氧化锰共热:
${KClO_{3}->[MnO_{2}][加热]KCl + O_{2}}$
。(2) 发生装置。
发生装置选择的依据:
反应物状态
和反应条件
。|药品|①高锰酸钾;②氯酸钾和二氧化锰|过氧化氢溶液和二氧化锰|
|--|--|--|
|反应物状态、反应条件|固体、加热|固体和液体、不需要加热|
|发生装置|||
(3) 收集装置。
|收集方法|向上排空气法|排水法|
|--|--|--|
|依据|氧气的密度比空气的
略大
,且不与空气成分反应|氧气不易
溶于水,且不与水反应|

|收集装置|||
(4) 实验步骤:检查
装置气密性
→装入药品→固定装置→点燃酒精灯进行加热→收集氧气。(5) 氧气的检验:将带火星的木条
伸入
集气瓶内
,木条复燃,证明是氧气。(6) 氧气的验满:用排水法收集时,当集气瓶口有
大气泡向外冒出
时,证明氧气已收集满;用向上排空气法收集时,将带火星的木条放在
集气瓶口
,木条复燃,证明氧气已收集满。

答案:
2.(1)加热高锰酸钾:${KMnO_{4}->[加热]K_{2}MnO_{4} + MnO_{2} + O_{2}}$;双氧水分解:${H_{2}O_{2}->[MnO_{2}]H_{2}O + O_{2}}$;氯酸钾和二氧化锰共热:${KClO_{3}->[MnO_{2}][加热]KCl + O_{2}}$ (2)反应物状态 反应条件 (3)略大 不易 (4)装置气密性 (5)伸入 内 (6)大气泡向外冒出 放在 口
查看更多完整答案,请扫码查看


