【题目】在“质量守恒定律”的课堂教学中,教师引导学生进行“化学反应中,反应物与生成物的质量关系”的实验探究。下图中实验装置和选用药品均为教材图示,现有A、B、C、D四个实验分别由甲、乙、丙、丁四个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
(1)A实验:白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡,结论是质量不守恒.等锥形瓶冷却后,重新放到托盘天平上称量,天平平衡,结论是质量守恒.你认为结论正确的是 (填“前一种”或“后一种”),而导致另一种结论错误的原因是 。
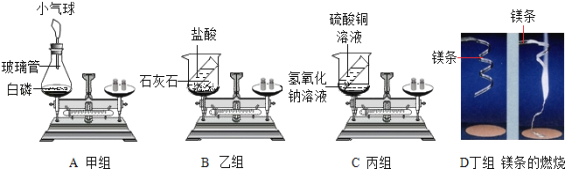
(2)丙组同学认为C实验说明了质量守恒.请你从原子的角度说明守恒的原因: 。乙、丁两组同学得到的错误结论是“B、D两个实验说明质量不守恒” 。教师引导学生分析了B、D两个实验的原因。你认为B实验不平衡的原因是 ;D实验不平衡的原因是 。
(3)通过对上述实验的探究,你得到的启示是:有气体参加或生成的反应,在验证质量守恒定律时应该在 中进行实验。
参考答案:
【答案】(1)后一种;白磷燃烧放出的热量使气体受热膨胀,小气球胀大产生浮力,使得天平不平衡(2)因为反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变;反应后生成的CO2逸出,使得天平不平衡;参加反应的氧气没有称量,使得前后质量不相等(3)密闭容器
【解析】
试题分析∶根据所学知识和题中信息知,(1)A实验:白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡,结论是质量不守恒.等锥形瓶冷却后,重新放到托盘天平上称量,天平平衡,结论是质量守恒.你认为结论正确的是后一种 。而导致另一种结论错误的原因是白磷燃烧放出的热量使气体受热膨胀,小气球胀大产生浮力,使得天平不平衡。(2)丙组同学认为C实验说明了质量守恒.请你从原子的角度说明守恒的原因:因为反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。乙、丁两组同学得到的错误结论是“B、D两个实验说明质量不守恒” 。教师引导学生分析了B、D 两个实验的原因。你认为B实验不平衡的原因是反应后生成的CO2逸出,使得天平不平衡。D实验不平衡的原因是参加反应的氧气没有称量,使得前后质量不相等。(3)通过对上述实验的探究,你得到的启示是:有气体参加或生成的反应,在验证质量守恒定律时应该在密闭容器中进行实验。
考点∶考查实验探究质量守恒定律。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小林同学收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如图所示.请回答以下问题。
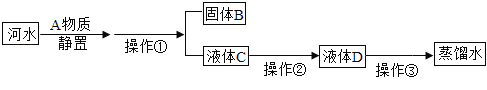
(1)A物质的名称是 ,操作①的名称是 ,进行该操作时用到铁架台、玻璃棒、烧杯、 等仪器,其中玻璃棒的作用是 ;若经过操作①后,所得液体C中仍有浑浊,写出一种可能的原因 。
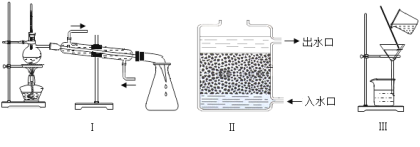
(2)操作②应选用的装置是 (填下图中的序号,下同),该过程主要是 变化(填“物理”或“化学”)。
(3)小林取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是 水。操作③应选用的装置是 (填序号),经过操作③以后,小林重复上述实验加少量肥皂水,他观察到的实验现象是 。
(4)节约用水从我做起,请任举一种生活中节约用水的措施: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验现象的描述与实验事实不相符的是
A. 木炭在氧气中燃烧时发出白光
B. 红磷在空气中燃烧时产生大量的白雾
C. 硫在氧气中燃烧时发出明亮的蓝紫色火焰
D. 一氧化碳燃烧产生蓝色火焰,生成使澄清石灰水变浑浊的气体
-
科目: 来源: 题型:
查看答案和解析>>【题目】在X2Y和YZ2中,Y的质量分数分别为40%和50%,则X2YZ3中Y的质量分数为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】日常生活中的下列变化,属于化学变化的是:( )
A. 西瓜榨汁 B. 风油精挥发 C. 纸张燃烧 D. 雪糕融化
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列获得氧气的方法中不含有分解反应的是:
A.用氯酸钾制氧气 B.分离液态空气制氧气
C.用双氧水制氧气 D.用高锰酸钾制氧气
-
科目: 来源: 题型:
查看答案和解析>>【题目】小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号
KClO3的质量
其他物质的质量
温度
氧气的体积
反应所需时间
①
2.0g
330℃
100mL
t1
②
2.0g
CuO 0.5g
330℃
100mL
t2
③
2.0g
MnO2 0.5g
330℃
100mL
t3
④
2.0g
MnO2 g
380℃
100mL
t4
序号
KClO3的质量
其他物质的质量
温度
氧气的体积
反应所需时间
①
2.0g
330℃
100mL
t1
②
2.0g
CuO 0.5g
330℃
100mL
t2
③
2.0g
MnO2 0.5g
330℃
100mL
t3
④
2.0g
MnO2 __ g
380℃
100mL
t4
【分析与结论】
(1)若t1 t2(填“>”、“=”、“<”),说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的 和 不变。
(2)你认为小雨设计实验③和实验②对比的目的是 。
(3)实验④中MnO2的质量为 g,若t3>t4,则化学反应快慢与温度的关系是 。
(4)写出实验④所涉及的化学方程式 。
(5)同种催化剂。颗粒大小也可能影响氯酸钾的分解速率,请设计实验方案进行验证。
相关试题

