【题目】某同学配制50g 6% 氯化钠溶液,整个操作过程如下图所示,回答下列问题:
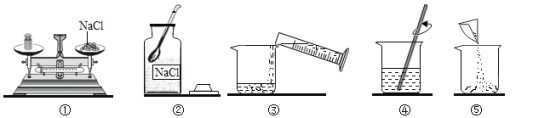
(1)其中操作错误的是_________(填序号)。
(2)图②中盛放氯化钠固体的仪器名称是________。
(3)量水时选用的量筒的量程最合适的是_________(选填字母),读数时视线要与量筒内_________保持水平。
A.10mL B.25mL C.50mL D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 _________(填序号)
A.氯化钠固体不纯 B .用生锈砝码称量 C.装瓶时有少量溶液洒出 D.溶解时烧杯内壁有水珠
参考答案:
【答案】① 广口瓶 C 凹液面的最低处 AD
【解析】
(1)托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了;
(2)图②中盛放氯化钠固体的仪器名称是广口瓶;
(3)溶剂质量=溶液质量-溶质质量,所需溶剂的质量为50g-3g=47g(合47mL),应用规格为50mL的量筒量取水的体积;量筒读数时视线要与凹液面的最低处保持水平;
(4)A、氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故选项正确;
B、用生锈砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,故选项不选;
C、溶液具有均一性,装瓶时有少量溶液洒出,溶质质量分数不变,故选项不选;
D、溶解时烧杯内壁有水珠,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项正确。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将50gCaCl2溶液与60gNa2CO3溶液混合后,恰好完全反应。过滤得到100g滤液。请计算:
(1)反应后生成CaCO3沉淀的质量为___________;
(2)反应后所得溶液中溶质的质量分数___________。(结果精确到0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质溶解度曲线如图所示,下列说法正确的是( )
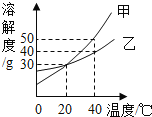
A. 40℃时,甲溶液中溶质的质量分数一定比乙溶液的大
B. 将40℃时甲、乙的饱和溶液降温至20℃,析出晶体较多的是甲
C. 甲的溶解度大于乙的溶解度
D. 40℃时,分别在100g水中各加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】等质量的铁和锌两种金属,分别与相同浓度的足量稀盐酸反应,生成氢气的质量和反应时间的关系如图所示,则下列说法中不正确的是( )
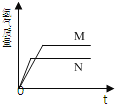
A. M、N中较活泼的金属是N
B. M、N中产生氢气较多的是M
C. M表示金属铁
D. N表示金属锌
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是一些常见物质的相互转化关系图,图中反应全部为置换反应,其中甲、乙属于盐类,请根据上图填空:

(1)写出D的化学式:___________;
(2)写出图中生成甲的化学反应方程式____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,在未名化学教研团队老师指导下设计并进行了如下实验。
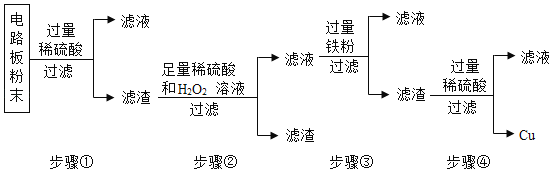
已知:Cu+H2O2+H2SO4 ═ CuSO4+2H2O;不考虑金、银发生类似反应.
(1)将电路板粉碎成粉末的目的是_______________。
(2)步骤①所得滤液中的溶质除硫酸外,还有______________。
(3)步骤②中的实验现象是:固体部分溶解,_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(提出问题)某化学兴趣小组通过未名化学教研团队的老师了解到碳和浓硫酸在加热条件下会发生反应生成水、二氧化硫和另一种气体。他们决定对这种未知气体进行探究。
(作出假设)小红认为该气体可能是CO2,她的依据是_____。你认为还可能是_______。
(查阅资料)
(1)SO2通入澄清石灰水会产生白色浑浊。
(2)SO2会使品红溶液褪色
(3)高锰酸钾溶液可以吸收SO2
(实验)
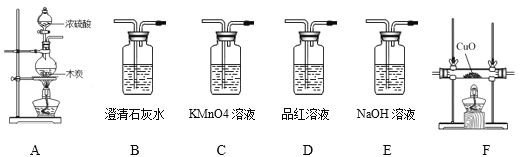
装置连接顺序为:A-C-D-B-E-B-F-B,D的作用是___________。若F装置中无现象,请写出碳和浓硫酸反应的化学方程式:__________。
相关试题

