【题目】将50gCaCl2溶液与60gNa2CO3溶液混合后,恰好完全反应。过滤得到100g滤液。请计算:
(1)反应后生成CaCO3沉淀的质量为___________;
(2)反应后所得溶液中溶质的质量分数___________。(结果精确到0.1%)
参考答案:
【答案】10g 11.7%
【解析】
(1)根据质量守恒定律分析生成的CaCO3沉淀的质量;
(2)根据反应的化学方程式,由CaCO3沉淀的质量可以求出生成氯化钠的质量;根据溶质质量的计算公式求出所得溶液中溶质的质量分数进行解答。
解:(1)根据质量守恒定律可知,反应后生成CaCO3沉淀的质量为:50g+60g-100g=10g;(2)设生成NaCl的质量为x,
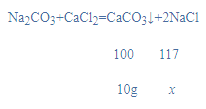
![]()
x=11.7g,
所得溶液中溶质的质量分数为![]() ×100%=11.7%。
×100%=11.7%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙、丁、戊分别是HCl、Na2SO4、Ba(NO3)2、NaOH、BaCl2五种溶液中的一种。现利用X溶液加以鉴别,其中白色沉淀Ⅱ不溶于稀硝酸。它们之间存在如下图所示的转化关系:
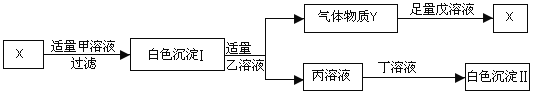
请填空:
(1)写出X的化学式:_____________;
(2)写出Y与足量戊溶液反应的化学方程式:________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某矿石由MgO、Fe2O3、CuO、SiO2组成,先将矿石粉碎,再用它制备氢氧化镁,流程示意图如图所示:
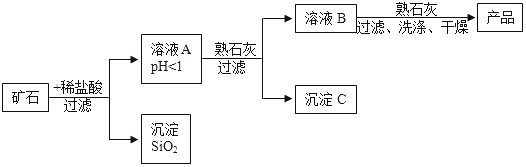
(1)矿石粉碎的目的是___________。
(2)溶液A中共含有________种阳离子。
(3)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。
氢氧化物
Fe(OH)3
Cu(OH)2
Mg(OH)2
开始沉淀的pH
1.5
4.2
8.6
完全沉淀的pH
3.2
6.7
11.1
为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为__________,溶液B中一定含有的溶质为_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们发现新鲜的苹果汁在空气中放置一段时间后会变色,仿佛铁生锈一样。于是,研究性小组同学设计并进行实验,探究苹果汁变色的原因。
(查阅资料)
a.苹果汁中含有0.001%的二价铁物质,同时也含有多酚类物质,多酚可与空气中的氧气反应变为褐色。
b.二价铁在空气中或与浓硝酸反应都能变为三价铁,且三价铁的溶液为黄色
c.硫氰化钾(KSCN)溶液变色规律
药品
二价铁溶液
三价铁溶液
KSCN溶液
不变色
变红色
(猜想与假设)
Ⅰ.苹果汁变色与苹果中的铁元素有关
Ⅱ.苹果汁变色是苹果汁中的多酚物质与空气中的氧气反应的结果
(进行实验)
编号
实验操作
实验现象
实验1
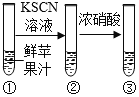
②中未出现明显变化
③:
实验2
分别放置于空气中一段时间(如下图所示)

试管编号
1min
10min
24小时
①
黄褐色
褐色
深褐色
②
无明显变化
无明显变化
无明显变化
③
略有些黄色
浅黄
黄色
实验3
(解释与结论) (1)实验1验证了苹果汁中含有二价铁物质。在该实验中③的现象是______________。
(2)实验2的②中FeSO4溶液溶质的质量分数为________%,该实验得出的结论是________。
(3)若试验3验证猜想Ⅱ成立的操作是:在除去氧气的空气中放置一段时间鲜苹果汁。则现象是:______________。
(反思与评价)
(4)写出一种防止苹果汁变色的方法:______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质溶解度曲线如图所示,下列说法正确的是( )
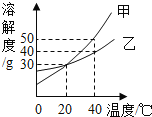
A. 40℃时,甲溶液中溶质的质量分数一定比乙溶液的大
B. 将40℃时甲、乙的饱和溶液降温至20℃,析出晶体较多的是甲
C. 甲的溶解度大于乙的溶解度
D. 40℃时,分别在100g水中各加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】等质量的铁和锌两种金属,分别与相同浓度的足量稀盐酸反应,生成氢气的质量和反应时间的关系如图所示,则下列说法中不正确的是( )
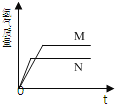
A. M、N中较活泼的金属是N
B. M、N中产生氢气较多的是M
C. M表示金属铁
D. N表示金属锌
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学配制50g 6% 氯化钠溶液,整个操作过程如下图所示,回答下列问题:
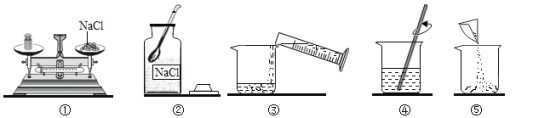
(1)其中操作错误的是_________(填序号)。
(2)图②中盛放氯化钠固体的仪器名称是________。
(3)量水时选用的量筒的量程最合适的是_________(选填字母),读数时视线要与量筒内_________保持水平。
A.10mL B.25mL C.50mL D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 _________(填序号)
A.氯化钠固体不纯 B .用生锈砝码称量 C.装瓶时有少量溶液洒出 D.溶解时烧杯内壁有水珠
相关试题

